Reaksi-reaksi
elektrolisis terjadi dalam wahana elektrolisis, yaitu saat aliran
listrik mulai dialirkan hingga merata di kedua kutub (katode dan anode).
Reaksi di katode berbeda dengan reaksi di anode. Reaksi elektrolisis
jika dalam larutan elektrolit berlangsung lebih kompleks dari
reaksi-reaksi kimia biasa lho, karena belum tentu unsur di kation atau
anionnya yang mengalami reaksi, mungkin saja air atau elektrodenya yang
bereaksi.
A. Faktor-faktor terjadinya reaksi-reaksi elektrolisis
- Spesi yang mengalami reduksi di katode adalah yang mempunyai potensial reduksi (E°) lebih positif (+)
- Spesi yang mengalami oksidasi di anode adalah yang mempunyai potensial oksidasi (E°) lebih negatif (-)
- Jenis elektrode, inert (tidak dapat bereaksi; ex = Pt, C, Au) atau aktif (dapat bereaksi sempurna)
- Potensial tambahan yang diperlukan sehingga reaksi elektrolisis dapat berlangsung (overpotensial)
- Dalam reaksi-reaksi elektrolisis ditemukan gas-gas yang terbentuk, yaitu gas hirogen, oksigen, fluor, dan klor.
B. Reaksi elektrolisis di katode (reduksi)
Reaksi di
katode semuanya berlangsung pada ion kation (ex: ion Na+ pada cairan
atau lelehan NaCl maupun NaBr). Nah, jenis-jenis reaksi elektrolisis di
katode terbagi atas, jika logam aktif dan logam tak aktif, seperti yang
dijelaskan di bawah ini:

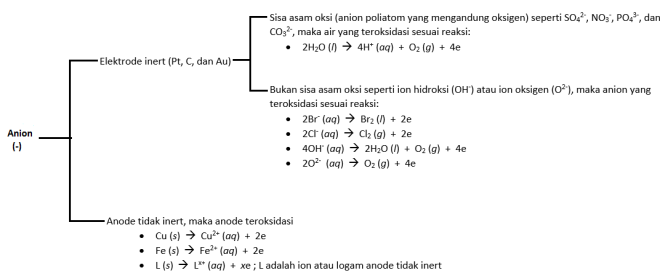
C. Reaksi elektrolisis di anode (oksidasi)
Reaksi di
anode semuanya berlangsung pada ion anion (ex: ion Cl- pada NaCl).
Ingat, bahwa elektrode (Pt, C, Au) ikut bereaksi hanya di anode, di
katode tidak terjadi reaksi! Nah, gambar di bawah ini menunjukkan
reaksi-reaksi di anode:
Contoh soal: (untuk memahaminya, perhatikan petunjuk reaksi-reaksi di katode dan anode)
- Elektrolisis terhadap larutan berikut ini yang dapat menghasilkan gas hidrogen di anode adalah …
A. AgNO3 (aq)
B. Na2SO4 (aq)
C. NaH (aq)
D. MgCl2 (aq)
E. KI (aq)
–> Pembahasan:

- Lelehan Al2O3 dielektrolisis dengan elektrode grafit (C) pada kedua batang yang dicelupkan seperti pada gambar.
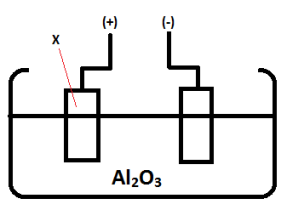
Reaksi yang terjadi di X adalah …
A. 2O2- –> O2 + 4e
B. Al3+ + 3e –> Al
C. 2H2O –> 4H+ + O2 + 4e
D. 4OH- –> 2H2O + 4e + O2
E. 2H2O + 2e –> 2OH- + H2
–> Pembahasan:
Susunan elektrolisis pada gambar dicelupkan elektrode C, artinya elektrode tidak bereaksi pada anion. Sip. Pada bagian X adalah reaksi yang terjadi pada kutub positif, yaitu anode. Nah, pada anode pasti terjadi proses reduksi jenis anion. Pada soal terdapat senyawa Al2O3, yang terdapat kation Al3+ dan anion O2-. Nah, anion O2- bukan termasuk sisa asam oksi, maka anion O2- yang teroksidasi, maka jawaban paling tepat adalah A. - Pada elektrolisis larutan NaCl dengan elektrode platina (Pt), di katode terjadi reaksi …
A. Na+ + e –> Na
B. 2Cl- –> Cl2 + 2e
C. NaCl –> Na+ + Cl-
D. 2H2O –> 4H+ + O2 + 4e
E. 2H2O + 2e –> H2 + 2OH-
–> Pembahasan:
Elektrolisisnya dilakukan terhadap “larutan” NaCl, artinya air bisa saja tereduksi atau teroksidasi di reaksi ini. Namun, elektrode platina adalah elektrode inert dan tidak ikut bereaksi. Nah, karena yang ditanya reaksi di katode (kation), maka kationnya adalah ion Na+ dan termasuk logam aktif, maka air yang tereduksi. - Larutan 1 M AgNO3, Cu(NO3)2, dan
Au(NO3)2 dielektrolisis dalam suatu peralatan dirangkai seri seperti
pada gambar di bawah sehingga setiap larutan dialiri arus listrik sama
besar.
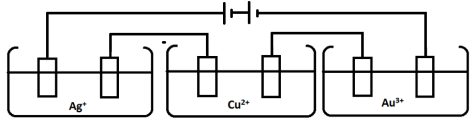
Jika 0,1 mol padatan Cu terbentuk, banyaknya mol Ag dan Au yang terbentuk dalam wahana elektrolisis adalah …
A. 0,05 mol Ag dan 0,075 mol Au
B. 0,05 mol Ag dan 0,15 mol Au
C. 0,1 mol Ag dan 0,1 mol Au
D. 0,2 mol Ag dan 0,067 mol Au
E. 0,2 mol Ag dan 0,25 mol Au
–> Pembahasan:

- Pada elektrolisis cairan natrium klorida, pada katode dan anode berturut-turut dibebaskan …
A. H2 dan Cl2
B. H2 dan O2
C. Na dan Cl2
D. Na dan H2
E. Na dan O2
–> Pembahasan:
Elektrolisis “cairan” sama dengan lelehan, artinya air maupun elektrode tidak ikut tereduksi atau teroksidasi. Natrium klorida (NaCl) memiliki kation Na+ dan anion Cl-. Nah, terjadi reaksi:
*Katode: Na+ + e –> Na
*Anode: 2Cl- –> Cl2 + 2e - Perhatikan gambar berikut!
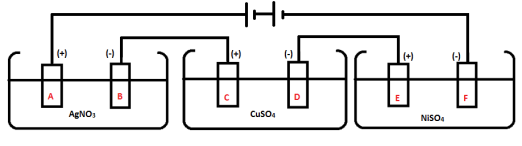 Ketiga
wadah diisi oleh larutan AgNO3, CuSO4, dan NiSO4 yang berkonsentrasi
0,1 M. Aliran listrik mengalir sebesar 1 A agar reaksi berlangsung tidak
terlalu cepat dan menghasilkan serpihan logam Ag, Cu, dan Ni yang
sempurna. Pasangan elektrode logam inert yang menghasilkan gas adalah …
Ketiga
wadah diisi oleh larutan AgNO3, CuSO4, dan NiSO4 yang berkonsentrasi
0,1 M. Aliran listrik mengalir sebesar 1 A agar reaksi berlangsung tidak
terlalu cepat dan menghasilkan serpihan logam Ag, Cu, dan Ni yang
sempurna. Pasangan elektrode logam inert yang menghasilkan gas adalah …
A. A dan B
B. A dan C
C. B dan E
D. C dan D
E. D dan E
–> Pembahasan:

- Ketika larutan encer air garam dielektrolisis, suatu gas tidak berwarna dilepaskan dari anode. Gas tersebut adalah …
A. Uap
B. Klorin
C. Oksigen
D. Hidrogen
E. Karbon dioksida
–> Pembahasan:
Larutan air garam belum tentu mempunyai rumus NaCl, karena NaCl adalah garam dapur, bukan air garam. Nah, pada elektrolisis air garam, gas yang timbul di anode adalah hasil dari teroksidasinya air, artinya pada anode air garam adalah sisa asam oksi. Reaksi di anode pada sisa asam oksi adalah 2H2O –> 4H+ + O2 + 4e; dilepaskan gas oksigen. - Suatu
larutan tembaga (II) sulfat dielektrolisis menggunakan elektrode karbon.
Endapan berwarna kemerahan yang terbentuk pada salah satu elektrode
adalah …
A. Tembaga
B. Tembaga (I) oksida
C. Temaga (II) oksida
D. Tembaga (II) sulfida
E. Tembaga (III) sulfida
–> Pembahasan:
Tembaga (II) sulfat, CuSO4, dielektrolisis dengan elektrode karbon, maka elektrodenya tidak bereaksi di anode dan katode. Nah, Endapan berwarna kemerahan dimiliki oleh unsur tembaga, yaitu di katode sesuai reaksi Cu2+ + 2e –> Cu.



No comments:
Post a Comment