Ikatan Kovalen Adalah adanya pemakaian secara bersama elektron yang berikatan oleh dua atom.
Jenis Ikatan kovalen berdasarkan jumlah pasangan elektron yang berikatan di bagi atas tiga:
1. ikatan kovalen tunggal
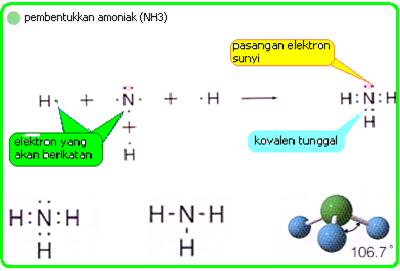
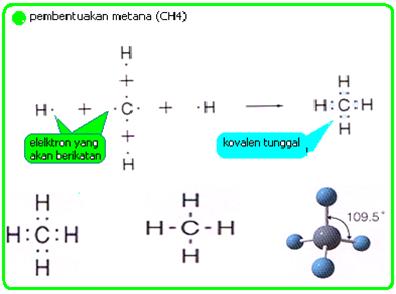
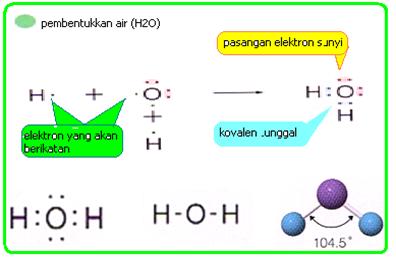
Adanya pemakaian satu pasang elektron oleh dua atom, misalnya adalah NH3, CH4. H2O.
Amoniak,Metana dan air: tiga contoh ikatan kovalen tunggal 2. ikatan kovalen rangkap dua
Ikatan ini melibatkan dua pasang elektron yang diguanakan secara bersama-sama. Contoh senyawa ikatan kovalen rangkap dua adalah O2 dan CO2.
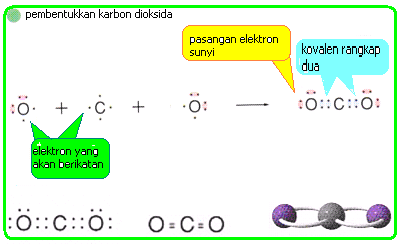
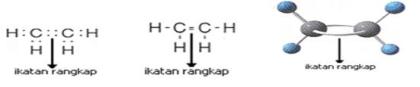
3. ikatan kovalen rangkap tiga
Ikatan ini melibatkan tiga pasang elektron yang digunakan secara bersama-sama. Contoh senyawa kovalen rangkap tiga adalah N2 dan C2H2.
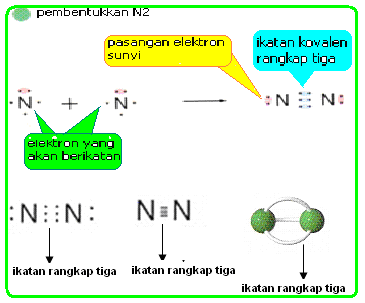
1. ikatan kovalen tunggal
Adanya pemakaian satu pasang elektron oleh dua atom, misalnya adalah NH3, CH4. H2O.
Amoniak,Metana dan air: tiga contoh ikatan kovalen tunggal 2. ikatan kovalen rangkap dua
Ikatan ini melibatkan dua pasang elektron yang diguanakan secara bersama-sama. Contoh senyawa ikatan kovalen rangkap dua adalah O2 dan CO2.


3. ikatan kovalen rangkap tiga
Ikatan ini melibatkan tiga pasang elektron yang digunakan secara bersama-sama. Contoh senyawa kovalen rangkap tiga adalah N2 dan C2H2.

Ikatan Kovalen Polar dan Non Polar
Ikatan kovalen polar
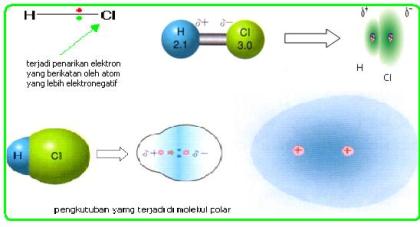
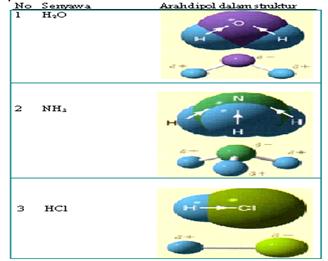
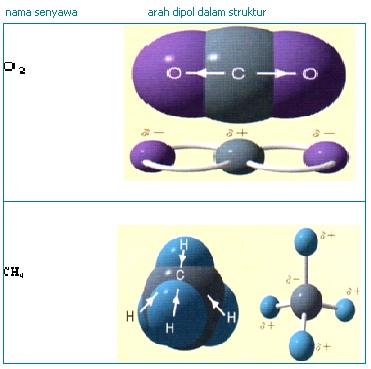
Ikatan kovalen polar adalah suatu ikatan kovalen dimana elektron-elektron yang membentuk ikatan lebih banyak menghabiskan waktunya untuk berputar dan berkeliling disekitar salah satu atom. Pada molekul HCl elektron yang berikatan akan lebih dekat kepada atom klor daripada Hidrogen. Polaritas ikatan ini dapat digambarkan dalam bentuk panah atau symbol δ+ , δ-. δ+ adalah tanda bahwa atom lebih bersifat elektropositif di banding dengan atom yang menjadi pasangannya. δ- berarti bahaw atom lebih bersifat elektronegatif daripada atom yang menjadi pasangan ikatannya. Lihat harga kelektronegtaifan tiap unsur pada tabel pauling
Ikatan kovalen nonpolar
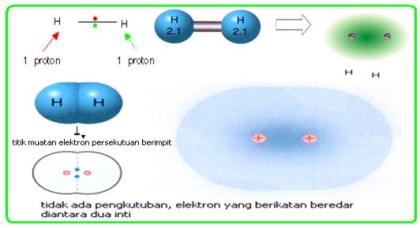
Kovalen murni (non polar) adalah memiliki ciri Titik muatan negatif elektron persekutuan berhimpit, sehingga pada molekul pembentukuya tidak terjadi momen dipol, dengan perkataan lain bahwa elektron persekutuan mendapat gaya tarik yang sama
Struktur H2 dan CO2 adalah contoh ikatan kimia non polar karena daya tariknya seimbang baik antara H dengan H atau antar O dengan C kiri dan kanan seimbang. Sehingga momen dipolnya menjadi nol Contoh lain adalah senyawa CH4, H2, O2, Br2 dan lain-lain
Ikatan kovalen polar adalah suatu ikatan kovalen dimana elektron-elektron yang membentuk ikatan lebih banyak menghabiskan waktunya untuk berputar dan berkeliling disekitar salah satu atom. Pada molekul HCl elektron yang berikatan akan lebih dekat kepada atom klor daripada Hidrogen. Polaritas ikatan ini dapat digambarkan dalam bentuk panah atau symbol δ+ , δ-. δ+ adalah tanda bahwa atom lebih bersifat elektropositif di banding dengan atom yang menjadi pasangannya. δ- berarti bahaw atom lebih bersifat elektronegatif daripada atom yang menjadi pasangan ikatannya. Lihat harga kelektronegtaifan tiap unsur pada tabel pauling
Ikatan kovalen nonpolar
Kovalen murni (non polar) adalah memiliki ciri Titik muatan negatif elektron persekutuan berhimpit, sehingga pada molekul pembentukuya tidak terjadi momen dipol, dengan perkataan lain bahwa elektron persekutuan mendapat gaya tarik yang sama
Struktur H2 dan CO2 adalah contoh ikatan kimia non polar karena daya tariknya seimbang baik antara H dengan H atau antar O dengan C kiri dan kanan seimbang. Sehingga momen dipolnya menjadi nol Contoh lain adalah senyawa CH4, H2, O2, Br2 dan lain-lain



No comments:
Post a Comment