
Dasar-dasar
asam-basa sudah dipelajari di SMP, terutama identifikasi senyawa
asam-basa. Kali ini, di SMA asam-basa diperluas hingga pengukuran pH.
Seperti diketahui ya, asam-basa banyak ditemukan di kehidupan
sehari-hari, dan, menjadi akar dari kimia hehe.
A. Sifat-sifat asam
- Memiliki pH dibawah 7 (pH <7)
- Berasa masam, yang diketahui melalui uji organoleptik (dicicipi) hanya untuk asam lemah
- Korosif, artinya dapat merusak berbagai benda logam dan nonlogam, serta dapat merusak jaringan tubuh (asam kuat). Korosif ini bergantung terhadap banyaknya ion proton (H+) yang terlepas dari larutan asam kuat
- Dalam air akan terurai menjadi ion proton (H+) dan sisa asam (anion; ion negatif) seperti HCl terurai menjadi H+ dan Cl-
- Dapat mengubah lakmus biru menjadi merah
- Dapat bereaksi dengan logam
- Dapat bereaksi dengan basa
B. Sifat-sifat basa
- Berasa pahit, seperti pada sabun
- Akan terasa licin dan berkerut jika terkontak dengan kulit
- Bersifat kaustik, yaitu dapat merusak kulit dan mengakibatkan rasa gatal
- Mengubah kertas lakmus merah jadi biru
- Dalam air terionisasi menjadi ion hidroksida (OH-) dan sisa basa (ion logam) seperti NaOH terurai menjadi Na+ dan OH-
- Dapat bereaksi dengan asam menghasilkan garam dan air
C. Identifikasi asam-basa
Indikator asam-basa ada yang alami dan buatan, namun indikator alami sangatlah banyak, so tabel di bawah ini adalah indikator asam-basa buatan yang telah ditemukan hingga kini:
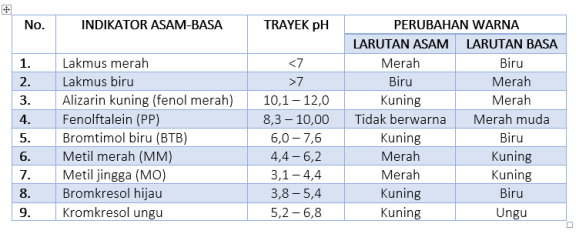
CONTOH SOAL:
- Pengujian suatu larutan menggunakan beberapa indikator alami menghasilkan data sebagai berikut.
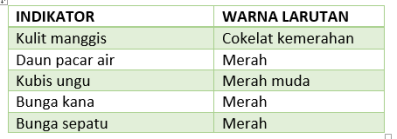 Larutan tersebut kemungkinan berupa …
Larutan tersebut kemungkinan berupa …
A. HCl
B. KNO3
C. BaSO4
D. NH4OH
E. Ba(OH)2
–> Pembahasan: HCl adalah suatu jenis asam kuat. Warna larutan pada soal lebih menujukkan ke warna merah (walaupun cokelat kemerahan terlihat merah; warna batu bata), artinya warna merah tsb menunjukkan perubahan sifat larutan asam. Jika sifat larutan basa, dominan ke warna biru - Data pengujian larutan dengan kertas lakmus diperoleh data berikut.
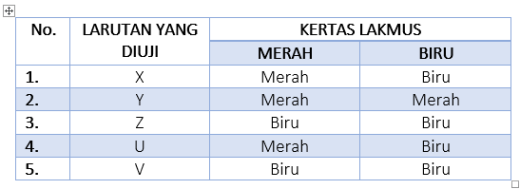 Larutan yang mengandung konsentrasi ion hidroksida (OH-) lebih besar daripada konsentrasi ion proton (H+) adalah …
Larutan yang mengandung konsentrasi ion hidroksida (OH-) lebih besar daripada konsentrasi ion proton (H+) adalah …
A. Z dan V
B. Y dan U
C. U dan X
D. X dan Z
E. X dan Y
–> Pembahasan: Jika konsentrasi ion hidroksida > konsentrasi ion proton, maka bersifat basa; nah jika konsentrasi H+ > OH- maka bersifat asam. Kalau kedua konsentrasi ion sama, maka bersifat netral - Manakah satu di antara pernyataan berikut yang kurang tepat tentang asam?
A. Mempunyai rasa masam
B. Tergolong elektrolit kuat
C. Korosif
D. Dapat menetralkan basa
E. pH < 7
–> Pembahasan: Semua asam tidak tergolong elektrolit kuat, ada juga yang termasuk elektrolit lemah seperti asam lemah - Suatu indikator memberi warna merah dengan larutan kapur sirih. Indikator ini akan berwarna merah juga dalam …
A. Air jeruk
B. Air sabun
C. Larutan cuka (CH3COOH)
D. Larutan gula
E. Larutan garam dapur (NaCl)
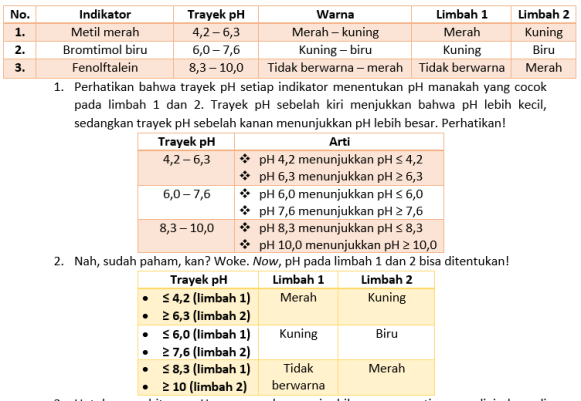
–> Pembahasan: Larutan kapur sirih adalah jenis basa, yang juga bersifat sama dengan air sabun - Perhatikan data uji pH dua sampel air limbah berikut!
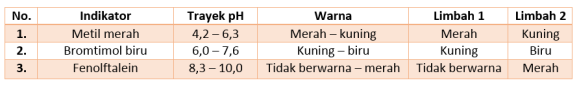 Berdasarkan hasil pengujian, pH air limbah 1 dan 2 berturut-turut adalah …
Berdasarkan hasil pengujian, pH air limbah 1 dan 2 berturut-turut adalah …
A. pH ≤ 8,3 dan pH ≥ 10
B. pH ≤ 4,2 dan pH ≥ 10,0
C. 4,2 ≤ pH 8,3 dan pH ≥ 10,0
D. pH ≤ 4,2 dan 6,3 ≤ pH ≤ 10,0
E. 4,2 ≤ pH ≤ 8,3 dan 6,3 ≤ pH ≤ 10,0
–> Pembahasan:

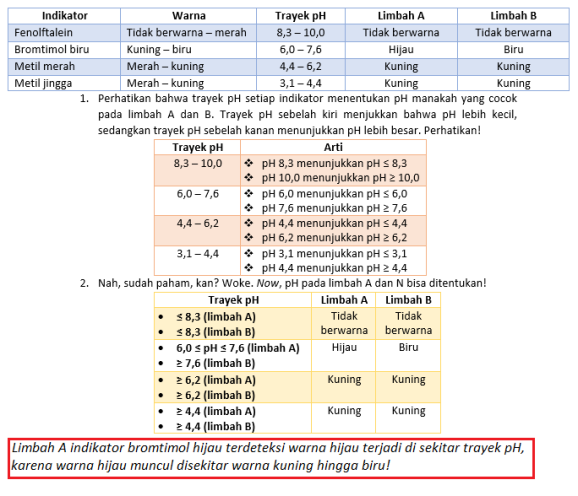
- Berikut ini data trayek pH dan perubahan warna indikator air limbah daerah A dan B pada waktu yang sama.
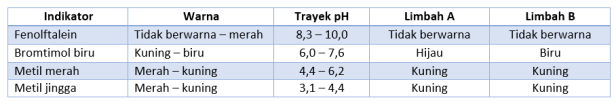 Berdasarkan data di atas, pH larutan A dan B berturut-turut adalah …
Berdasarkan data di atas, pH larutan A dan B berturut-turut adalah …
A. ≤ 4,4 dan 7,6 ≤ pH ≤ 8,3
B. 6,0 ≤ pH ≤ 7,6 dan pH ≥ 8,3
C. 6,2 ≤ pH ≤ 7,6 dan 7,6 ≤ pH ≤ 8,3
D. 6,2 ≤ pH ≤ 8,3 dan 7,6 ≤ pH ≤ 8,3
E. 7,6 ≤ pH ≤ 8,3 dan pH ≥ 8,3
–> Pembahasan:
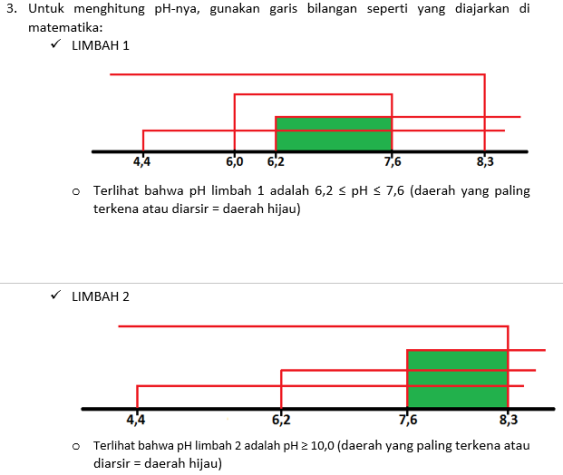



No comments:
Post a Comment