Dari beberapa referensi dan tutorial yang ada di layanan video dalam jaringan (
online)
youtube dapat disimpulkan beberapa pola atom yang akan berperan sebagai
atom pusat dalam struktur Lewis suatu molekul. Atom H dan F tidak
pernah berperan sebagai atom pusat.
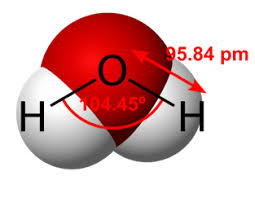
- Molekul yang memiliki atom tunggal maka atom tunggal itu yang biasanya akan berperan sebagai atom pusat.
Contoh:
H2O → O
CH4 → C
NO3– → N
XeF4 → Xe
MnO4– → Mn
CrO2F2– → Cr
ClO4- → Cl
→ (dibaca "atom pusatnya adalah")
- Molekul yang memiliki atom tunggal lebih dari 1 maka yang berperan
adalah atom tunggal yang valensinya lebih tinggi, jika terdapat logam
transisi sebagai atom tunggal maka ia yang dapat prioritas sebagai atom
pusat.
Contoh:
POCl3 → P.
P atom trivalen, O atom divalen, Cl atom monovalen.
NCO– → C
VOCl3 → V
Valensi di sini dimaknai sebagai jumlah elektron yang digunakan untuk
berikatan dengan atom lain dalam suatu molekul/ion. C atom tetravalen, N
dan P atom trivalen, O atom divalen, F, Cl, biasa sebagai monovalen.
- Molekul yang memiliki 2 atom tunggal atau lebih namun valensinya
sama maka atom yang lebih besar (berada di periode lebih besar pada
sistem periodik unsur) akan lebih berhak sebagai atom pusat.
Contoh:
SOCl2 → S, S satu golongan dengan O, sama-sama atom divalen, S
berada di bawah O (S berada di periode 3 sementara itu O berada di
periode 2 atau boleh dengan alasan S memiliki jari-jari atom lebih
besar).
- Perkecualian:
N2O → N
Meskipun O jumlahnya 1 tetapi jari-jari N lebih
besar atau elektronegativitas N (3,04 skala Pauling) lebih kecil
dibanding O (3,44 skala Pauling).
CNO- (ion fulminat) → N
Ketiganya jumlah atomnya sama,
pada ion fulminat N mengambil posisi sebagai atom pusat walaupun ini
tidak stabil (secara fakta memang ada ion fulminat ini), berbeda pada
ion sianat (NCO-) yang lebih stabil. Mengapa N sebagai atom pusat pada ion fulminat ini, penulis belum mendapatkan argumen yang meyakinkan?
S2O → S
Meskipun O jumlahnya 1 tetapi jari-jari S lebih besar atau
elektronegativitas S (2,58 skala Pauling) lebih kecil dibanding O (3,44
skala Pauling).
S2O32– → S
Alasannya karena S memiliki jari-jari atom lebih besar atau elektronegativitasnya lebih kecil dibandingkan O.
NSF → S
Alasannya karena S memiliki jari-jari atom lebih besar atau elektronegativitasnya lebih kecil dibandingkan N dan F.
Demikian semoga bermanfaat untuk pemelajar kimia jenjang SMA.







No comments:
Post a Comment