A. pH
pH (power of hydrogen) digunakan untuk mengukur keasaman suatu zat kimia, yang ditemukan oleh Soren Peter Lauritz Sorensen. Nilai pH terbentang dari 0 hingga 14, namun ada pH yang berada di bawah nol dan lebih tinggi dari 14 yang disebut pH ekstrim. Nah, dalam perhitungan pH diingat kembali konsep logaritma di matematika. Berikut rumus pH:
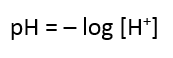
Rentang pH terbagi atas 3, yaitu:
- pH < 7 = termasuk pH asam (asam kuat dan lemah)
- pH = 7 = termasuk pH netral (garam bersifat kuat dari asam kuat dan basa kuat)
- pH > 7 = termasuk pH basa (basa kuat dan lemah)
B. pOH
pOH
digunakan untuk mengukur kebasaan suatu zat yang bersifat basa. Nah,
dalam perhitungan asam-basa, pOH jarang sekali (bahkan sangat jarang)
untuk ditentukan kebasaan zatnya. Maka dari itu, kebasaan suatu zat
kimia yang bersifat basa, pOH harus diubah ke pH.
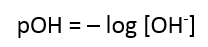
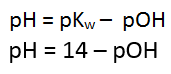
C. Kw
Kw adalah
tetapan kesetimbangan air, yaitu besar konsentrasinya sebesar 10^-14 (^ =
pangkat), atau jika dalam pKw sebesar 14. Konsep Kw didapatkan dari
daya hantar listrik pelarut air yang begitu besar karena sebagian kecil
terionisasi menjadi ion H+ dan OH- berdasarkan reaksi berikut.
H2O (l) ⇆ H+ (aq) + OH- (aq)
Nah, tetapan
kesetimbangan (Kc) ionisasi air pada reaksi di atas sama dengan tetapan
kesetimbangan air (Kw) seperti pada gambar di bawah:
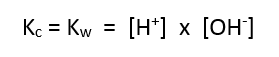
Konsep dari Kw ini mengacu pada pergeseran kesetimbangan kimia, yaitu:
- Apabila ditambahkan suatu zat asam (ambil saja ion H+), maka konsentrasi asam tsb akan bertambah, namun nilai Kw tetap 10^-14 karena berdasarkan reaksi di atas kesetimbangan akan bergeser ke kiri yang menyebabkan pengurangan [OH-], atau dengan kata lain [H+] bertambah dan [OH-] berkurang alias saling menyimbangi nilai Kw
- Begitu juga dengan penambahan zat basa (ambil saja ion OH-), maka konsentrasi basa tsb bertambah, nilai Kw-nya tetap karena kesetimbangan bergeser ke kiri juga, menyebabkan pengurangan [H+]
Dua konsep di atas bisa diperluas lagi berdasarkan gambar di bawah ini:

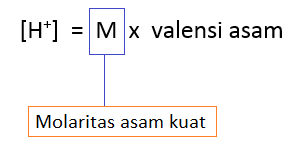
D. Perhitungan pH asam kuat
Asam terbagi
atas 2, yaitu asam kuat dan lemah. Dalam perhitungannya relatif mudah
dan rumusnya pun berbeda. Di bawah ini adalah ciri-ciri asam kuat:
- Mengion sempurna (derajat ionisasi atau α bernilai 1)
- pH-nya ditentukan dari konsentrasi larutan dan valensi asam (tentang valensi asam, klik)
- Dapat merusak kulit
- Bersifat korosif
- Semakin mendekati pH bernilai 1, maka dikatakan asam kuat
- Terkecuali asam sulfat (H2SO4) dapat mengion sempurna pada konsentrasi yang sangat encer
Di bawah ini adalah rumus dari perhitungan asam kuat, dan untuk mencari pH-nya scroll ke atas bagian tab “A. pH”.
E. Perhitungan pH basa kuat
Begitu juga dengan basa, yang terbagi atas 2, yaitu basa kuat dan lemah. Di bawah ini adalah ciri-ciri basa kuat:
- Perhitungannya ditentukan dari konsentrasi basa dan valensi basa ( (tentang valensi asam, klik)
- Semakin mendekati pH 14, maka basa tersebut bersifat basa kuat
Di bawah ini adalah rumus dari perhitungan asam kuat, dan untuk mencari pH-nya scroll ke atas bagian tab “B. pOH”.
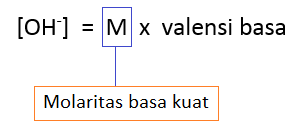
F. Pengenceran
Pengenceran
adalah percobaan kimia yang bertujuan untuk mengurasi konsentrasi zat
terlarut suatu zat dengan menambahkan suatu pelarut sambil mengeluarkan
panas agar diperoleh volume akhir yang lebih besar. Di bawah ini adalah
rumus pengenceran:

Di dalam pengenceran, berlaku:
- Jika pH naik 1, maka diencerkan 10 kali
- Jika pH naik 2, maka diencerkan 100 kali
- Kesimpulan bahwa, setiap kenaikan pH akan mengalami pengenceran 10 kali dari pengenceran awal
CONTOH SOAL:
- Pada suhu 100°C, harga tetapan kesetimbangan air adalah 5,1 x 10^-14. Konsentrasi ion OH- adalah …
A. 2,26 x 10^-7
B. 3,28 x 10^-7
C. 5,10 x 10^-7
D. 2,26 x 10^-7
E. 5,10 x 10^-14
–> Pembahasan: Pada penjelasan label “C. Kw” di atas, bahwa [H+] = [OH-] = akar dari tetapan kesetimbangan air (Kw) - Sebanyak 10 L larutan yang mengandung 0,1 mol H2SO4 memiliki pH sebesar …
A. 2 + log 2
B. 2 + log 1
C. 2 – log 2
D. 1 + log 1
E. 1 – log 2
–> Pembahasan:

- Massa HCl
yang harus dilarutkan ke dalam 200 mL akuades untuk memperoleh larutan
HCl dengan pH = 2 adalah … gram (Ar H = 1; Cl = 35,5)
A. 7,3
B. 0,73
C. 0,073
D. 0,0073
E. 0,00073
–> Pembahasan:

- Larutan asam nitrat (HNO3) 0,01 M bervolume 10 L diukur pH-nya menggunakan pH meter. Hasil akhir pH yang diukur adalah …
A. 1
B. 2
C. 3
D. 4
E. 5
–> Pembahasan: Masukin ke rumusnya langsung, ya! Yuk, latihan! - Suatu asam
kuat monovalen memiliki pH = 1. Jika diketahui kadar asam tersebut
adalah 0,485% dan massa jenisnya 1,3 gram/mL, nilai Mr asam kuat
tersebut adalah …
A. 36,5
B. 44
C. 58,5
D. 63,0
E. 98,0
–> Pembahasan:

- Diketahui data pOH senyawa berikut:
1) pOH larutan KOH = 2
2) pOH larutan NaOH = 3
3) pOH larutan Ba(OH)2 = 2 – log 2
4) pOH larutan Ca(OH)2 = 4
5) pOH larutan Mg(OH)2 = 0
Berdasarkan data di atas,senyawa yang bersifat paling basa adalah …
A. KOH
B. NaOH
C. Ca(OH)2
D. Mg(OH)2
E. Ba(OH)2
–> Pembahasan: Ingat, bahwa yang menentukan senyawa paling asam atau basa adalah pH, bukan pOH! So, kurangkanlah nilai pOH tersebut dengan 14. Jika mendekati pH = 14 adalah yang paling basa - Larutan KOH sebanyak 2 liter mempunyai pH sebesar 11 + log 3. Jumlah mol KOH tersebut adalah …
A. 8 x 10^-3
B. 6 x 10^-3
C. 4 x 10^-3
D. 3 x 10^-3
E. 2 x 10^-3
–> Pembahasan:

- Sebanyak 5
gram cuplikan yang mengandung NaOH dilarutkan dalam 200 mL akuades. Jika
pH larutan tersebut adalah 13 + log 5, maka kadar NaOH dalam cuplikan
adalah … % (Ar Na = 23; H = 1)
A. 80
B. 70
C. 60
D. 50
E. 40
–> Pembahasan:


- Jika konsetrasi ion H+ dalam suatu larutan = 0,002 M dan nilai log 2 = 0,3; maka pH larutan tersebut adalah …
A. 3,3
B. 2,7
C. 2,3
D. 1,7
E. 1,3
–> Pembahasan:
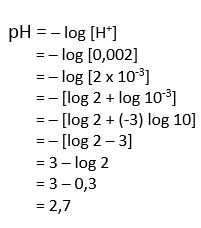
- Asam kuat mempunyai sifat sebagai berikut, kecuali …
A. Mempunyai nilai tetapan setimbang (Ka) yang besar
B. Merupakan konduktor yang baik
C. Mempunyai pH rendah
D. Mempunyai lebih dari satu atom H dalam molekulnya
E. Dapat melarutkan berbagai logam
–> Pembahasan: Obsein D paling tepat karena asam kuat HCl memiliki 1 atom H dalam molekulnya, tidak seperti H2SO4 (asam sulfat) yang punya 2 atom H dalam molekulnya - Larutan asam klorida dalam air dengan pH = 2 akan berubah menjadi pH = 3 bila diencerkan …
A. 10 kali
B. 5 kali
C. 3 kali
D. 2,5 kali
E. Pengenceran tidak memengaruhi pH
–> Pembahasan: pH suatu larutan naik satu, maka diencerkan 10 kali. Jika pH larutan naik dua (ex = pH dari 2 ke pH 4) maka diencerkan 100 kali. Begitu juga seterusnya. - Jika larutan HI dengan pH = 3 diencerkan 1000 kali, maka pH larutan tersebut menjadi …
A. 3
B. 4
C. 5
D. 6
E. 7
–> Pembahasan: Larutan HI tersebut diencerkan 1000 kali, artinya pH naik 3 kali dari semula, yaitu menjadi 6 - Apabila
larutan A memiliki pH = 3 dan larutan B memiliki pH = 5, maka
perbandingan konsentrasi ion hidroksida dalam larutan A dan B sebesar …
A. 3 : 5
B. 2 : 1
C. 1 : 2
D. 1 : 10
E. 1 : 100
–> Pembahasan:

- Sebanyak 0,74 gram Ca(OH)2 dilarutkan dalam 500 mL air. Jika Ar Ca = 40; O = 16; H = 1; maka pH larutan yang terbentuk sebesar …
A. 2 – log 4
B. 2 + log 4
C. 12 – log 4
D. 12 + log 4
E. 12 + log 2
–> Pembahasan:

- Suatu
larutan X berjenis asam kuat monovalen ber-pH sebesar 3, yang dilarutkan
dalam pelarut bervolume 100 L. Larutan X yang seberat 10,05 gram
tersebut adalah jenis senyawa …
A. HCl (Mr = 36,5)
B. HClO4 (Mr = 100,5)
C. HClO3 (Mr = 84,5)
D. H2SO4 (Mr = 98)
E. Tidak teridentifikasi
–> Pembahasan:

- Sebanyak 10 mL larutan HCl mengandung
18,25% berat HCl (massa jenis = 1,08 g/mL) diencerkan dengan penambahan
air hingga volumenya menjadi 500 mL. Apabila Mr HCl = 36,5 pH setelah
pengenceran adalah …
A. 1
B. 2
C. 3
D. 4
E. 5
–> Pembahasan:




No comments:
Post a Comment