Membaca diagram pada bahasan kimia bagi siswa kadang bukan hal yang
mudah. Kemampuan membaca diagram (data dalam bentuk diagram/kurva) yang
tersaji pada pokok bahasan tertentu dalam pelajaran kimia menjadi suatu
keharusan agar siswa dapat mempelajari gejala pada suatu proses hingga
dapat menarik kesimpulan. Pada tulisan ini akan sedikit diulas tentang
bagaimana membaca diagram-diagram yang biasa digunakan untuk pokok
bahasan termokimia dan laju reaksi dan juga penerapan pada soal-soal.
Secara kinetika reaksi A akan berjalan relatif lebih lambat dibanding B meskipun keduanya bereaksi secara eksotermis. Tingginya energi aktivasi B lebih rendah dibanding A, semakin rendah (kecil) energi aktivasi pada suatu reaksi kimia dapat diartikan bahwa reaksi tersebut berlangsung lebih cepat.
Berikut ini soal-soal terkait kemampuan membaca profil diagram energi.
 Soal #1.
Soal #1.
Manakah yang menunjukkan energi aktivasi reaksi balik pada diagram profil energi berikut?
A. x
B. y
C. x.y
D. x + y
E. x - y
Pembahasan #1:
Energi aktivasi reaksi balik pada diagram profil energi ditunjukkan oleh x+y (alternatif jawaban d yang tepat).
Soal #2.
Berikut ini adalah profil energi reaksi yang berlangsung dengan katalis dan tanpa katalis.
Manakah pernyataan yang sesuai dengan diagram profil energi?
 A. perubahan entalpi reaksi adalah (E2 – E3)
A. perubahan entalpi reaksi adalah (E2 – E3)
B. perubahan entalpi reaksi berkurang ketika katalis digunakan
C. reaksi katalisis ke depan bersifat endotermis
D. E4 adalah energi aktivasi untuk reaksi katalisis balik
E. E4 – E3 adalah perubahan entalpi reaksi
Pembahasan #2:
ΔH berdasarkan diagram profil energi dapat dihitung dari E2 – E3 atau E1 – E4. Katalis hanya mempercepat reaksi dengan memberikan alternatif cara/jalan reaksi dengan energi aktivasi lebih rendah, jadi ini tidak berpengaruh pada ΔH. Karena E3 energinya lebih rendah dari E2 maka reaksi ini akan menghasilkan kalor atau bersifat eksotermis.
Jawaban yang tepat a.
Soal #3
Pada diagram profil energi di samping merupakan tipe reaksi yang persamaan reaksinya
pereaksi⇌k1k−1produk
 Perubahan yang menyebabkan konstanta laju reaksi k1 dan k-1 menjadi meningkat:
Perubahan yang menyebabkan konstanta laju reaksi k1 dan k-1 menjadi meningkat:
1. Penambahan katalis
2. Pemanasan pada sistem kesetimbangan
3. Menambah konsentrasi pereaksi.
Alternatif jawaban yang benar adalah?
A. 1 saja
B. 2 saja
C. 3 saja
D. 1 dan 2
E. 2 dan 3
Pembahasan #3
Penambahan katalis akan menurunkan Ea, baik reaski maju (menuju produk) maupun reaksi balik (menuju pereaksi). Dengan turunnya nilai Ea nilai k1 maupun k-1 akan meningkat pula. Demikian pula pemanasan pada kesetimbangan akan mempercepat tercapainya kesetimbangan, sehingga konstanta laju reaksi kedua arah juga akan meningkat.
Jawaban yang tepat d.
Soal #4
Manakah profil diagram energi yang menunjukkan reaksi yang berlangsung cepat dan menghasilkan produk yang relatif stabil?
Pembahasan #4:
Secara kinetika reaksi akan berlangsung cepat jika energi aktivasinya rendah. Secara energitika produk yang stabil adalah produk reaksi ekosotermis, dengan kata lain energi produk jauh lebih rendah dibanding energi pereaksi.
Diagram A dan B merupakan profil diagram reaksi endotermis, diagram C, D, dan E merupakan profil diagram eksotermis. Antara C, D, E reaksi yang berlangsung sedikit lebih lambat adalah E (energi aktivasinya sedikit lebih besar dibanding S dan D). Antara C dan D perubahan energi yang lebih besar adalah C.
Jadi yang sesuai pertanyaan soal jawaban yang paling tepat adalah C
Soal #5
Pada diagram berikut, kurva R diperoleh ketika 100 mL H2O2 1 M terurai ketika ditambahkan suatu katalis MnO2.
2H2O2 → 2H2O + O2
Manakah kondisi yang menunjukkan perubahan kurva R pada percobaan menjadi kurva Q?
A. Penurunan suhu
B. Penambahan air
C. Penambahan sedikit 0,1 M H2O2
D. Penggunaan katalis MnO2 lebih sedikit
E. Tanpa menggunakan katalis
Pembahasan #5:
Kurva Q menunjukkan bahwa O2 yang terbentuk lebih banyak dan reaksi berlangsung lebih lambat (ini ditunjukkan dengan kemiringan kurva yang landai-tidak securam kurva R). Penambahan sedikit H2O2 0,1 M akan mengencerkan larutan H2O2 (ingat konsentrasi sebelumnya adalah 1 M) dan ini mengurangi laju reaksi (lebih lambat). Namun dengan penambahan H2O2 tadi secara keseluruhan akan meningkatkan jumlah H2O2 yang berakibat akan meningkat pula jumlah O2 yang terbentuk.
Soal diadaptasi dari berbagai sumber. CMIIW.
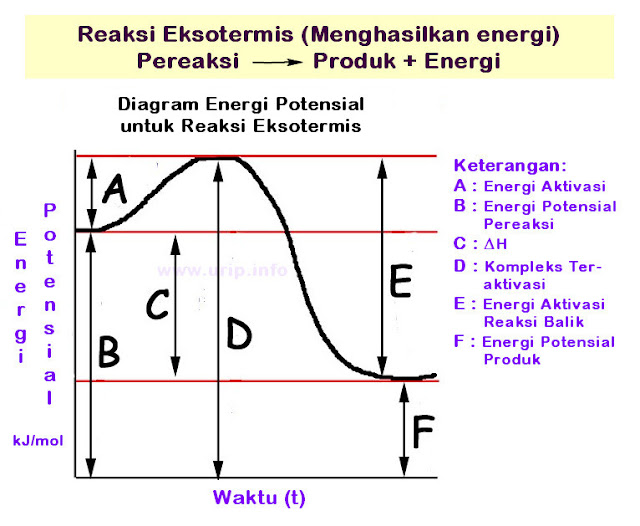
Energi
aktivasi secara singkat dapat diartikan sebagai energi yang diperlukan
untuk memulainya reaksi kimia, pada diagram, energi aktivasi adalah
energi yang diperlukan untuk mencapai "puncak bukit".
Energi potensial pereaksi adalah energi yang terdapat dalam pereaksi saat reaksi dimulai.
ΔH adalah energi yang dilepaskan atau diperlukan ketika reaksi terjadi.
ΔH (entalpi) = H produk - H pereaksi.
Bila ΔH = + (endotermis)
Bila ΔH = - (eksotermis)
Kompleks teraktivasi adalah puncak kurva yaitu energi maksimal pada reaksi
Energi aktivasi reaksi balik adalah energi yang diperlukan untuk reaksi arah sebaliknya.
Energi potensial produk adalah energi yang dikandung produk ketika reaksi selesai.
Energi potensial pereaksi adalah energi yang terdapat dalam pereaksi saat reaksi dimulai.
ΔH adalah energi yang dilepaskan atau diperlukan ketika reaksi terjadi.
ΔH (entalpi) = H produk - H pereaksi.
Bila ΔH = + (endotermis)
Bila ΔH = - (eksotermis)
Kompleks teraktivasi adalah puncak kurva yaitu energi maksimal pada reaksi
Energi aktivasi reaksi balik adalah energi yang diperlukan untuk reaksi arah sebaliknya.
Energi potensial produk adalah energi yang dikandung produk ketika reaksi selesai.
Secara kinetika reaksi A akan berjalan relatif lebih lambat dibanding B meskipun keduanya bereaksi secara eksotermis. Tingginya energi aktivasi B lebih rendah dibanding A, semakin rendah (kecil) energi aktivasi pada suatu reaksi kimia dapat diartikan bahwa reaksi tersebut berlangsung lebih cepat.
Berikut ini soal-soal terkait kemampuan membaca profil diagram energi.
 Soal #1.
Soal #1.Manakah yang menunjukkan energi aktivasi reaksi balik pada diagram profil energi berikut?
A. x
B. y
C. x.y
D. x + y
E. x - y
Pembahasan #1:
Energi aktivasi reaksi balik pada diagram profil energi ditunjukkan oleh x+y (alternatif jawaban d yang tepat).
Soal #2.
Berikut ini adalah profil energi reaksi yang berlangsung dengan katalis dan tanpa katalis.
Manakah pernyataan yang sesuai dengan diagram profil energi?
 A. perubahan entalpi reaksi adalah (E2 – E3)
A. perubahan entalpi reaksi adalah (E2 – E3)B. perubahan entalpi reaksi berkurang ketika katalis digunakan
C. reaksi katalisis ke depan bersifat endotermis
D. E4 adalah energi aktivasi untuk reaksi katalisis balik
E. E4 – E3 adalah perubahan entalpi reaksi
Pembahasan #2:
ΔH berdasarkan diagram profil energi dapat dihitung dari E2 – E3 atau E1 – E4. Katalis hanya mempercepat reaksi dengan memberikan alternatif cara/jalan reaksi dengan energi aktivasi lebih rendah, jadi ini tidak berpengaruh pada ΔH. Karena E3 energinya lebih rendah dari E2 maka reaksi ini akan menghasilkan kalor atau bersifat eksotermis.
Jawaban yang tepat a.
Soal #3
Pada diagram profil energi di samping merupakan tipe reaksi yang persamaan reaksinya
 Perubahan yang menyebabkan konstanta laju reaksi k1 dan k-1 menjadi meningkat:
Perubahan yang menyebabkan konstanta laju reaksi k1 dan k-1 menjadi meningkat:1. Penambahan katalis
2. Pemanasan pada sistem kesetimbangan
3. Menambah konsentrasi pereaksi.
Alternatif jawaban yang benar adalah?
A. 1 saja
B. 2 saja
C. 3 saja
D. 1 dan 2
E. 2 dan 3
Pembahasan #3
Penambahan katalis akan menurunkan Ea, baik reaski maju (menuju produk) maupun reaksi balik (menuju pereaksi). Dengan turunnya nilai Ea nilai k1 maupun k-1 akan meningkat pula. Demikian pula pemanasan pada kesetimbangan akan mempercepat tercapainya kesetimbangan, sehingga konstanta laju reaksi kedua arah juga akan meningkat.
Jawaban yang tepat d.
Soal #4
Manakah profil diagram energi yang menunjukkan reaksi yang berlangsung cepat dan menghasilkan produk yang relatif stabil?
Pembahasan #4:
Secara kinetika reaksi akan berlangsung cepat jika energi aktivasinya rendah. Secara energitika produk yang stabil adalah produk reaksi ekosotermis, dengan kata lain energi produk jauh lebih rendah dibanding energi pereaksi.
Diagram A dan B merupakan profil diagram reaksi endotermis, diagram C, D, dan E merupakan profil diagram eksotermis. Antara C, D, E reaksi yang berlangsung sedikit lebih lambat adalah E (energi aktivasinya sedikit lebih besar dibanding S dan D). Antara C dan D perubahan energi yang lebih besar adalah C.
Jadi yang sesuai pertanyaan soal jawaban yang paling tepat adalah C
Soal #5
Pada diagram berikut, kurva R diperoleh ketika 100 mL H2O2 1 M terurai ketika ditambahkan suatu katalis MnO2.
2H2O2 → 2H2O + O2
Manakah kondisi yang menunjukkan perubahan kurva R pada percobaan menjadi kurva Q?
A. Penurunan suhu
B. Penambahan air
C. Penambahan sedikit 0,1 M H2O2
D. Penggunaan katalis MnO2 lebih sedikit
E. Tanpa menggunakan katalis
Pembahasan #5:
Kurva Q menunjukkan bahwa O2 yang terbentuk lebih banyak dan reaksi berlangsung lebih lambat (ini ditunjukkan dengan kemiringan kurva yang landai-tidak securam kurva R). Penambahan sedikit H2O2 0,1 M akan mengencerkan larutan H2O2 (ingat konsentrasi sebelumnya adalah 1 M) dan ini mengurangi laju reaksi (lebih lambat). Namun dengan penambahan H2O2 tadi secara keseluruhan akan meningkatkan jumlah H2O2 yang berakibat akan meningkat pula jumlah O2 yang terbentuk.
Soal diadaptasi dari berbagai sumber. CMIIW.







No comments:
Post a Comment