Hello Sobat Dan Adik-Adik ! Salam Chemistry !! Pada panduan kali ini , mas dennis akan mengajarkan kepada adik-adik bagaimana caranya menghitung PH dari larutan asam kuat dan larutan asam lemah. Sebelumnya mas dennis pernah mengajarkan mengenai Tata Nama Senyawa Asam Dan Basa , jika adik-adik belum tahu silahkan di pelajari materi tersebut, tetapi bila adik-adik sudah tahu silahkan dilanjutkan membacanya.
Oke, untuk menemani adik-adik di saat mempelajari materi kali ini, silahkan siapkan biskuit go potato dan teh es ! hehehe... Oke sekarang mari kita masuk ke materi !
Cara Menghitung PH larutan Asam Kuat Dan Asam Lemah
Seperti yang sudah adik-adik ketahui sebelumnya , bahwa asam kuat itu merupakan asam yang dapat terionisasi sempurna di dalam air membentuk ion-ion. karena asam kuat dapat terionisasi sempurna di dalam air, maka PH yang dihasilkan oleh asam kuat akan jauh lebih rendah dibandingkan PH yang dihasilkan oleh asam lemah pada konsentrasi yang sama. Hal ini terjadi karena konsentrasi ion H+ dari asam kuat jauh lebih banyak dibandingkan konsentrasi ion H+ dari asam lemah.
Nah , untuk menghitung PH dari asam kuat, kita bisa gunakan rumus berikut :
PH = - Log [ H+ ]
Dimana H+ merupakan konsentrasi ion H+ dari asam kuat ( Dalam bentuk molaritas atau M )
Contoh Soal :
1. Hitunglah PH dari larutran Asam Klorida ( HCl ) 0,1 M !
Asam klorida maerupakan asam kuat yang dapat terionisasi sempurna di dalam air, berikut ini reaksi ionisasinya :
HCl >> H+ + Cl-
0,1 M 0,1 M
Maka PH dari Asam Klorida ialah :
2. Hitunglah PH dari larutan Asam Sulfat ( H2SO4 ) 0,2 M !
Asam Sulfat juga merupakan asam kuat yang dapat terionisasi sempurna di dalam air, berikut ini reaksi ionisasinya :
H2SO4 >> 2H+ + SO42-
2. ( 0,2 M ) ( 0,2 M )
0,4 M 0,2 M
Maka PH dari Asam Sulfat ialah :
Ok, jadi begitulah cara yang dapat adik-adik gunakan untuk menghitung PH dari larutan asam kuat tersebut. Sekarang , mari kita pelajari cara menghitung PH dari larutan asam lemah !
Karena asam lemah merupakan asam yang hanya dapat terionisasi sebagian membentuk ion-ion , maka sebelum kita mencari PH dari asam lemah tersebut, terlebih dahulu kita cari konsentrasi ion H+ dari asam lemah tersebut dengan menggunakan rumus :
Setelah kita cari konsentrasi ion H+ nya, barulah kita dapat menghitung PH dari asam lemah tersebut dengan menggunakan rumus :
PH = - Log [H+]
Contoh Soal :
1. Hitunglah PH dari larutan asam lemah HClO 0,1 M ! ( Dik Ka = 3,5 x 10>-8 )
Asam Hipoklorit merupakan asam lemah yang hanya dapat terionisasi sebagian membentuk ion-ion , berikut ini reaksi ionisasinya :
HClO >> H+ + ClO-
0,1 M x x
Pertama kita cari konsentrasi ion H+ nya :
Setelah itu kita cari PH dari larutan asam lemah tersebut dengan menggunakan rumus :
2. Hitunglah PH dari larutan Asam Format HCOOH 0,3 M ! ( Dik ; Ka = 1,8 x 10>-4 )
Asam Format merupakan asam lemah yang hanya dapat terionisasi sebagian membentuk ion-ion . berikut ini reaksi ionisasinya :
HCOOH >><< H+ + HCOO-
0,3 M x x
Pertama , kita cari konsentrasi ion H+ nya :
Setelah itu, kita cari PH dari asam lemah tersebut dengan menggunakan rumus :
Jadi , begitulah cara yang dapat adik-adik gunakan untuk menghitung PH dari larutan asam lemah tersebut.
Ok ,Demikianlah postingan mas dennis mengenai cara menghitung PH dari Asam Kuat Dan Asam Lemah , Semoga dapat bermanfaat bagi adik-adik semuanya, terima kasih ! dan Salam CHEMISTRY !!!





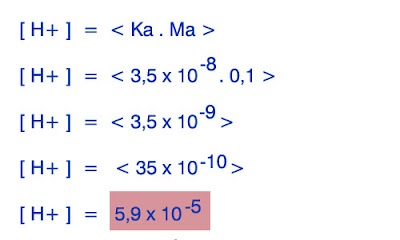



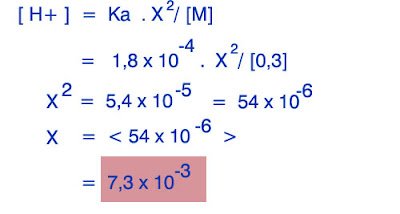



No comments:
Post a Comment