Soal – soal berikut akan menguji pemahaman kalian tentang :
1. Pengertian hukum dasar kimia yaitu hukum kekekalan massa, hukum perbandingan tetap, hukum perbandingan berganda, hukum Gay-Lussac dan hukum avogadro.
2. Menerapkan konsep hukum dasar kimia untuk menyelesaikan berbagai soal dalam kimia.
Soal – soal ini sangat cocok untuk dijadikan media latihan bagi siswa yang akan menghadapi ulangan harian atau bisa jadi panduan membuat soal ulangan harian bagi guru kimia. Dibagian akhir akan diberikan kunci jawaban.
Soal 1
“massa zat sebelum dan sesudah reaksi adalah sama”. Pernyataan diatas kemukakan oleh . . .
A. Antoin Laurent Lavoisier
B. Albert Einstein
C. John Dalton
D. John Jacob Berzelius
E. Joseph Louis Proust
Soal 2
Jika 4 gram karbon (arang) dibakar dengan oksiegn dalam wadah yang tertutup rapat, maka zat yang terbentuk adalah sebanyak . . . .gram
A. 2
B. 4
C. 6
D. 8
E. 10
Soal 3
Diantara reaksi – reaksi dibawah ini yang tidak mengikuti hukum kekekalan massa adalah . . . .
A. 5 gram belerang + 10 gram tembaga ==> 15 gram tembaga (II) sulfida
B. 2 gram belerang + 3,5 gram besi ==> 5,5 gram besi(II)sulfida)
C. 5 gram belerang + 10 gram oksigen ===> 10 gram belerang dioksida
D. 3 gram karbon + 8 gram oksigen ==> 11 gram karbon dioksida
E. 1 gram oksigen + 8 gram hidrogen ==> 9 gram air
Soal 4
Pada percobaan reaksi antara logam besi dan belerang, didapatkan data sebagai berikut :
Berdasarkan data diatas dapat disimpulkan bahwa nilai X dan Y berturut – turut adalah . . . .
A. 0,2 dan 0,6
B. 0,2 dan 0,8
C. 0,3 dan 0,6
D. 0,3 dan 0,8
E. 0,6 dan 0,8
Soal 5
Diketahui Ar Fe = 56 dan O = 16, maka perbandingan massa unsur besi dengan massa unsur oksigen dalam Fe2O3 adalah . . . .
A. 2 : 3
B. 3 : 2
C. 4 : 3
D. 3 : 4
E. 7 : 3
Soal 6
Belerang dan oksigen bersenyawa membentuk blerang trioksida dengan perbandingan belerang dan osigen 2 : 3. Jika 6 gram belerang direaksikan dengan 6 gram gas oksigen, pda akhir reaksi akan terdapat sisa . . . .
A. Tidak ada
B. 2 gram oksigen
C. 3 gram oksigen
D. 2 gram belerang
E. 3 gram belerang
Soal 7
Diberikan data reaksi sebagai berikut.
Perbandingan X dan Y dalam senyawa yang terbentuk adalah . . . .
A. 5 : 2
B. 5 : 3
C. 7 : 3
D. 7 : 2
E. 7 : 5
Soal 8
Perbandingan massa karbon dan oksigen dalam karbon dioksida adalah 3 : 8. Jika 6 gram karbon direaksikan dengan 20 gram oksigen, massa karbon dioksida yang terbentuk adalah . . . .
A. 13 gram
B. 22 gram
C. 26 gram
D. 27,5 gram 29 gram
Soal 9
Senyawa C12H22O11 mengandung unsur karbon, hidrogen dan oksigen. Massa karbon yang terdapat dalam 171 gram senyawa tersebut adalah . . . .(Ar H = 1, C = 12 dan O = 16)
A. 72 gram
B. 36 gram
C. 18 gram
D. 9 gram
E. 3 gram
Soal 10
Unsur P dan Q dapat membentuk senyawa dengan data sebagai berikut:
Menurut hukum perbandingan berganda dari Dalton, perbandingan massa Q pada senyawa I dan massa Q pada senyawa II adalah . . . .
A. 2 : 3
B. 2 : 5
C. 1 : 3
D. 1 : 2
E. 1 : 1
Soal 11
Dua senyawa terbentuk dari unsur fosfor dan oksigen. Salah satu senyawa terdiri dari 0,845 gram fosfor dan 0,655 gram oksigen. Jika senyawa lain terdiri dari 1,69 gram fosfor, massa oksigen yang diperlukan untuk emmenuhi hukum perbandingan berganda adalah . . . . .gram
A. 0,655
B. 0,745
C. 0,855
D. 0,985
E. 1,69
Soal 12
Pernyataan bahwa volume gas – gas yang bereaksi dan volume gas – gas hasil reaksi merupakan perbandingan bulat dan sederhana, bila diukur pada suhu dan tekanan yang sama dikemukakan oleh . . . .
A. Gay Lussac
B. Demokritus
C. Avogadro
D. Dalton
E. Lavoisier
Soal 13
Pada P dan T yang sama, perbandingan volume pereaksi dan hasil reaksi dari :
C3H7OH(g) + O2(g) ==> CO2(g) + H2O(g)
Berturut – turut adalah . . . .
A. 1 : 2 : 6 : 5
B. 2 : 5 : 8 : 9
C. 2 : 9 : 6 : 8
D. 3 : 6 : 9 : 8
E. 3 : 9 : 6 : 8
Soal 14
Perhatikan reaksi berikut :
C3H8(g) + O2(g) ==> CO2(g) + H2O(g) (belum setara)
Diketahui kadar gas oksigen di udara adalah 20% . untuk emmbakar 20 L gas C3H8, dibutuhkan udara sebanyak . . . .
A. 100 liter
B. 150 liter
C. 250 liter
D. 400 liter
E. 500 liter
Soal 15
Sebanyak 10 mL gas hidrokarbon (CxHy), padaP dan Tyang sama dibakar habis dengan 35 mL gas oksigen. Jika gas karbon dioksida yangdihasilkan adalah sebanyak 20 mL, rumus molekul hidrokarbon tersebut adalah . . . .
A. CH4
B. C2H4
C. C2H6
D. C3H6
E. C3H8
Soal 16
Diketahui beberapa persamaan reaksi berikut ini :
1. H2(g) + O2(g) ==> H2O(g)
2. N2(g) + H2(g) ==> NH3(g)
3. H2(g) + I2(g) ==> HI(g)
4. N2(g) + O2(g) ==> NO2(g)
5. SO2(g) + O2(g) ==> SO3(g)
(Reaksi diatas belum setara)
Pada P dan T yang sama, reaksi yang jumlah volume reaktan sama dengan jumlah volume produk adalah . . . .
A. 1
B. 2
C. 3
D. 4
E. 5
Soal 17
Pada suhu dan tekanan tertentu, m molekul H2S bervolume 0,25 L. pada suhu dan tekanan yang sama, volume 4m molekul NH3 adalah . . . .
A. 0,25 L
B. 0,5 L
C. 1 L
D. 1,5 L
E. 2 L
Soal 18
Pada suhu dan tekanan tertentu, 2 L gas nitrogen mengandung n molekul gas nitrogen. Pada suhu dan tekanan yang sama, jumlah molekul gas oksigen yang bervolume 10 L adalah . . . . .
A. n molekul gas oksigen
B. 1,5 n molekul gas oksigen
C. 3n molekul gas oksigen
D. 5n molekul gas oksigen
E. 10n molekul gas oksigen
Soal 19
Perbandingan molekul nitrogen dan hidrogen dalam pembentukan NH3 adalah 1 : 3. Bila volume nitrogen yang bereaksi adalah 8 L, maka volume hidrogen yang direaksikan adalah . . . . Liter
A. 4
B. 6
C. 8
D. 12
E. 24
Soal 20
Jumlah partikel dalam 0,25 mol N2 sama dengan jumlah partikel dalam . . . .
A. 1,25 mol O2
B. 1 mol P4
C. 0,75 mol C4H10
D. 0,25 mol CO2
E. 0,5 mol Na
Kunci Jawaban
1. A
2. B
3. C
4. A
5. E
6. D
7. C
8. B
9. A
10. A
11. A
12. A
13. C
14. E
15. C
16. C
17. E
18. D
19. E
20. B
1. Pengertian hukum dasar kimia yaitu hukum kekekalan massa, hukum perbandingan tetap, hukum perbandingan berganda, hukum Gay-Lussac dan hukum avogadro.
2. Menerapkan konsep hukum dasar kimia untuk menyelesaikan berbagai soal dalam kimia.
Soal – soal ini sangat cocok untuk dijadikan media latihan bagi siswa yang akan menghadapi ulangan harian atau bisa jadi panduan membuat soal ulangan harian bagi guru kimia. Dibagian akhir akan diberikan kunci jawaban.
Soal 1
“massa zat sebelum dan sesudah reaksi adalah sama”. Pernyataan diatas kemukakan oleh . . .
A. Antoin Laurent Lavoisier
B. Albert Einstein
C. John Dalton
D. John Jacob Berzelius
E. Joseph Louis Proust
Soal 2
Jika 4 gram karbon (arang) dibakar dengan oksiegn dalam wadah yang tertutup rapat, maka zat yang terbentuk adalah sebanyak . . . .gram
A. 2
B. 4
C. 6
D. 8
E. 10
Soal 3
Diantara reaksi – reaksi dibawah ini yang tidak mengikuti hukum kekekalan massa adalah . . . .
A. 5 gram belerang + 10 gram tembaga ==> 15 gram tembaga (II) sulfida
B. 2 gram belerang + 3,5 gram besi ==> 5,5 gram besi(II)sulfida)
C. 5 gram belerang + 10 gram oksigen ===> 10 gram belerang dioksida
D. 3 gram karbon + 8 gram oksigen ==> 11 gram karbon dioksida
E. 1 gram oksigen + 8 gram hidrogen ==> 9 gram air
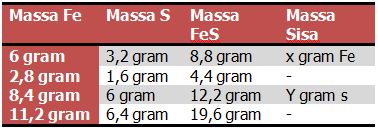
Soal 4
Pada percobaan reaksi antara logam besi dan belerang, didapatkan data sebagai berikut :
Berdasarkan data diatas dapat disimpulkan bahwa nilai X dan Y berturut – turut adalah . . . .
A. 0,2 dan 0,6
B. 0,2 dan 0,8
C. 0,3 dan 0,6
D. 0,3 dan 0,8
E. 0,6 dan 0,8
Soal 5
Diketahui Ar Fe = 56 dan O = 16, maka perbandingan massa unsur besi dengan massa unsur oksigen dalam Fe2O3 adalah . . . .
A. 2 : 3
B. 3 : 2
C. 4 : 3
D. 3 : 4
E. 7 : 3
Soal 6
Belerang dan oksigen bersenyawa membentuk blerang trioksida dengan perbandingan belerang dan osigen 2 : 3. Jika 6 gram belerang direaksikan dengan 6 gram gas oksigen, pda akhir reaksi akan terdapat sisa . . . .
A. Tidak ada
B. 2 gram oksigen
C. 3 gram oksigen
D. 2 gram belerang
E. 3 gram belerang
Soal 7
Diberikan data reaksi sebagai berikut.
Perbandingan X dan Y dalam senyawa yang terbentuk adalah . . . .
A. 5 : 2
B. 5 : 3
C. 7 : 3
D. 7 : 2
E. 7 : 5
Soal 8
Perbandingan massa karbon dan oksigen dalam karbon dioksida adalah 3 : 8. Jika 6 gram karbon direaksikan dengan 20 gram oksigen, massa karbon dioksida yang terbentuk adalah . . . .
A. 13 gram
B. 22 gram
C. 26 gram
D. 27,5 gram 29 gram
Soal 9
Senyawa C12H22O11 mengandung unsur karbon, hidrogen dan oksigen. Massa karbon yang terdapat dalam 171 gram senyawa tersebut adalah . . . .(Ar H = 1, C = 12 dan O = 16)
A. 72 gram
B. 36 gram
C. 18 gram
D. 9 gram
E. 3 gram
Soal 10
Unsur P dan Q dapat membentuk senyawa dengan data sebagai berikut:
Menurut hukum perbandingan berganda dari Dalton, perbandingan massa Q pada senyawa I dan massa Q pada senyawa II adalah . . . .
A. 2 : 3
B. 2 : 5
C. 1 : 3
D. 1 : 2
E. 1 : 1
Soal 11
Dua senyawa terbentuk dari unsur fosfor dan oksigen. Salah satu senyawa terdiri dari 0,845 gram fosfor dan 0,655 gram oksigen. Jika senyawa lain terdiri dari 1,69 gram fosfor, massa oksigen yang diperlukan untuk emmenuhi hukum perbandingan berganda adalah . . . . .gram
A. 0,655
B. 0,745
C. 0,855
D. 0,985
E. 1,69
Soal 12
Pernyataan bahwa volume gas – gas yang bereaksi dan volume gas – gas hasil reaksi merupakan perbandingan bulat dan sederhana, bila diukur pada suhu dan tekanan yang sama dikemukakan oleh . . . .
A. Gay Lussac
B. Demokritus
C. Avogadro
D. Dalton
E. Lavoisier
Soal 13
Pada P dan T yang sama, perbandingan volume pereaksi dan hasil reaksi dari :
C3H7OH(g) + O2(g) ==> CO2(g) + H2O(g)
Berturut – turut adalah . . . .
A. 1 : 2 : 6 : 5
B. 2 : 5 : 8 : 9
C. 2 : 9 : 6 : 8
D. 3 : 6 : 9 : 8
E. 3 : 9 : 6 : 8
Soal 14
Perhatikan reaksi berikut :
C3H8(g) + O2(g) ==> CO2(g) + H2O(g) (belum setara)
Diketahui kadar gas oksigen di udara adalah 20% . untuk emmbakar 20 L gas C3H8, dibutuhkan udara sebanyak . . . .
A. 100 liter
B. 150 liter
C. 250 liter
D. 400 liter
E. 500 liter
Soal 15
Sebanyak 10 mL gas hidrokarbon (CxHy), padaP dan Tyang sama dibakar habis dengan 35 mL gas oksigen. Jika gas karbon dioksida yangdihasilkan adalah sebanyak 20 mL, rumus molekul hidrokarbon tersebut adalah . . . .
A. CH4
B. C2H4
C. C2H6
D. C3H6
E. C3H8
Soal 16
Diketahui beberapa persamaan reaksi berikut ini :
1. H2(g) + O2(g) ==> H2O(g)
2. N2(g) + H2(g) ==> NH3(g)
3. H2(g) + I2(g) ==> HI(g)
4. N2(g) + O2(g) ==> NO2(g)
5. SO2(g) + O2(g) ==> SO3(g)
(Reaksi diatas belum setara)
Pada P dan T yang sama, reaksi yang jumlah volume reaktan sama dengan jumlah volume produk adalah . . . .
A. 1
B. 2
C. 3
D. 4
E. 5
Soal 17
Pada suhu dan tekanan tertentu, m molekul H2S bervolume 0,25 L. pada suhu dan tekanan yang sama, volume 4m molekul NH3 adalah . . . .
A. 0,25 L
B. 0,5 L
C. 1 L
D. 1,5 L
E. 2 L
Soal 18
Pada suhu dan tekanan tertentu, 2 L gas nitrogen mengandung n molekul gas nitrogen. Pada suhu dan tekanan yang sama, jumlah molekul gas oksigen yang bervolume 10 L adalah . . . . .
A. n molekul gas oksigen
B. 1,5 n molekul gas oksigen
C. 3n molekul gas oksigen
D. 5n molekul gas oksigen
E. 10n molekul gas oksigen
Soal 19
Perbandingan molekul nitrogen dan hidrogen dalam pembentukan NH3 adalah 1 : 3. Bila volume nitrogen yang bereaksi adalah 8 L, maka volume hidrogen yang direaksikan adalah . . . . Liter
A. 4
B. 6
C. 8
D. 12
E. 24
Soal 20
Jumlah partikel dalam 0,25 mol N2 sama dengan jumlah partikel dalam . . . .
A. 1,25 mol O2
B. 1 mol P4
C. 0,75 mol C4H10
D. 0,25 mol CO2
E. 0,5 mol Na
Kunci Jawaban
1. A
2. B
3. C
4. A
5. E
6. D
7. C
8. B
9. A
10. A
11. A
12. A
13. C
14. E
15. C
16. C
17. E
18. D
19. E
20. B





No comments:
Post a Comment