Soal 1
Molekul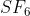 mempunyai bentuk oktahedral. Jika diketahui nomor atom S = 16, bentuk orbital hibrida
mempunyai bentuk oktahedral. Jika diketahui nomor atom S = 16, bentuk orbital hibrida 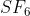 adalah . . . .
adalah . . . .
A.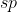
B.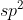
C.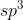
D.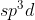
E.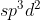
Pembahasan :
Molekul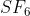 mempunyai bentuk oktahedral. Dalam molekul
mempunyai bentuk oktahedral. Dalam molekul 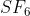 yang menjadi :
yang menjadi :
Atom pusat = S (nomor atom 16)
Konfigurasi S =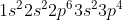
Atom S akan berikatan tunggal dengan F(nomor atom 9), karena jumlah elektron valensi F adalah 7 sehingga hanya membutuhkan satu buah elektron lagi agar stabil secara oktet.
Konfigurasi F =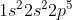
Diagram Orbital :
Atom S berkewajiban untuk menyediakan enam buah orbital yang berisi elektron tidak berpasanan agar bisa berikatan dengan enam bua atom F. Pada bentuk dasar seperti gambar diatas, atom S hanya mempunyai dua orbital yang terisi elektron yang tidak berpasangan. Untuk menyediakan 4 orabital lagi, maka masing masing satu buah elektron pada sub kulit 3s dan 3p diseksitasi / promosi / dipindahkan ke orbital 3d sehingga tercipta orbital baru (orbital hibrida) yang memiliki enam buah elektron tidak berpasangan pada orbitalnya.
Agar lebih paham perhatikanlah gambar dibawah ini :
Orbital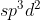 yang sudah berisi enam buah elektron menyendiri akan ditempai oleh enam buah elektron dari atom F
yang sudah berisi enam buah elektron menyendiri akan ditempai oleh enam buah elektron dari atom F
Jawaban : E
Soal 2
Orbital hibrida dimiliki oleh senyawa . . . . .(nomor atom : B = 5, Cl =17, S = 16, F = 9, P =15 dan H = 1)
A.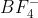
B.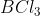
C.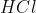
D.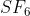
E.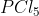
Pembahasan :
Untuk menentukan senyawa yang memiliki orbital hibrida, berarti kita cek satu persatu option jawabannnya (sekalian berlatih agar lebih paham ya....semangat)
Pada Senyawa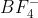 Yang menjadi :
Yang menjadi :
Atom pusat = B (nomor atom 5)
Karean molekul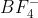 adalah ion poliatomik yang bermuatan - 1, artinya satu buah elektron telah diterima oleh atom B, sehingga konfigurasi dan diagram orbitalnya dalam keadaan ion adalah sebagai berikut :
adalah ion poliatomik yang bermuatan - 1, artinya satu buah elektron telah diterima oleh atom B, sehingga konfigurasi dan diagram orbitalnya dalam keadaan ion adalah sebagai berikut :
Wah ternyata molekul memiliki orbital hibrida (beruntunggnya.....coba jawabannya E, kan lebih pajang lagi caranya....saran saya cek secara acak saja optionnya....siapa tau ketemu lebih cepat...haha)
Kita coba satu buah lagi ya, agar kita menjadi lebih paham . . .saya pilih HCl (ada alasan khusus)
Ternyata pada molekul HCl, atom Cl sudah mempunyai satu orbital berisi elektron yang tidak berpasangan, sehingga atom H dapat langsung berikatan dengan atom Cl tanpa melaui proses hibridisasi.
Jawaban : A
Soal 3
Atom pusat dalam molekul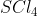 mengalami hibridisasi . . . . .(nomor atom S = 16 dan Cl = 17)
mengalami hibridisasi . . . . .(nomor atom S = 16 dan Cl = 17)
A.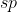
B.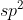
C.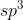
D.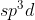
E.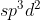
Pembahasan :
Pada molekul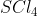 :
:
Konfigurasi elektron :
S (atom pusat) =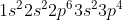
Cl =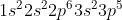
Keadaan Dasar (atom pusat S)
Atom S harus menyediakan 4 orbital berisi elektron yang tidak berpasangan , sehingga sebuah elektron dari subkulit 3p (terluar) akan dieksitasikan ke orbital 3d.
Jawaban : D
Soal 4
Unsur X(nomor atom 15) dan Y (nomor atom 9) saling berikatan satu sama lain membentuk senyawa kovalen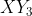 . Hibridisasi yang terjadi dan bentuk molekul adalah . . . .
. Hibridisasi yang terjadi dan bentuk molekul adalah . . . .
Molekul
A.
B.
C.
D.
E.
Pembahasan :
Molekul
Atom pusat = S (nomor atom 16)
Konfigurasi S =
Atom S akan berikatan tunggal dengan F(nomor atom 9), karena jumlah elektron valensi F adalah 7 sehingga hanya membutuhkan satu buah elektron lagi agar stabil secara oktet.
Konfigurasi F =
Diagram Orbital :
Atom S berkewajiban untuk menyediakan enam buah orbital yang berisi elektron tidak berpasanan agar bisa berikatan dengan enam bua atom F. Pada bentuk dasar seperti gambar diatas, atom S hanya mempunyai dua orbital yang terisi elektron yang tidak berpasangan. Untuk menyediakan 4 orabital lagi, maka masing masing satu buah elektron pada sub kulit 3s dan 3p diseksitasi / promosi / dipindahkan ke orbital 3d sehingga tercipta orbital baru (orbital hibrida) yang memiliki enam buah elektron tidak berpasangan pada orbitalnya.
Agar lebih paham perhatikanlah gambar dibawah ini :
Orbital
Jawaban : E
Soal 2
Orbital hibrida dimiliki oleh senyawa . . . . .(nomor atom : B = 5, Cl =17, S = 16, F = 9, P =15 dan H = 1)
A.
B.
C.
D.
E.
Pembahasan :
Untuk menentukan senyawa yang memiliki orbital hibrida, berarti kita cek satu persatu option jawabannnya (sekalian berlatih agar lebih paham ya....semangat)
Pada Senyawa
Atom pusat = B (nomor atom 5)
Karean molekul
Wah ternyata molekul memiliki orbital hibrida (beruntunggnya.....coba jawabannya E, kan lebih pajang lagi caranya....saran saya cek secara acak saja optionnya....siapa tau ketemu lebih cepat...haha)
Kita coba satu buah lagi ya, agar kita menjadi lebih paham . . .saya pilih HCl (ada alasan khusus)
Ternyata pada molekul HCl, atom Cl sudah mempunyai satu orbital berisi elektron yang tidak berpasangan, sehingga atom H dapat langsung berikatan dengan atom Cl tanpa melaui proses hibridisasi.
Jawaban : A
Soal 3
Atom pusat dalam molekul
A.
B.
C.
D.
E.
Pembahasan :
Pada molekul
Konfigurasi elektron :
S (atom pusat) =
Cl =
Keadaan Dasar (atom pusat S)
Atom S harus menyediakan 4 orbital berisi elektron yang tidak berpasangan , sehingga sebuah elektron dari subkulit 3p (terluar) akan dieksitasikan ke orbital 3d.
Jawaban : D
Soal 4
Unsur X(nomor atom 15) dan Y (nomor atom 9) saling berikatan satu sama lain membentuk senyawa kovalen
A.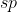
B.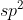
C.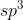
D.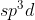
E.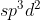
Pembahasan :
Molekul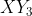 dengan atom pusat X
dengan atom pusat X
Konfigurasi elektron :
X (nomor atom 15) =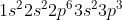 =
= ![[Ne]3s^{2}3p^{3}](https://latex.codecogs.com/gif.latex?[Ne]3s^{2}3p^{3})
Y (nomor atom 9 ) =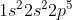 =
= ![[He]2s^{2}2p^{5}](https://latex.codecogs.com/gif.latex?[He]2s^{2}2p^{5})
Keadaan dasar (atom X)
Atom X mengalami hibridisasi tanpa meaui proses eksitasi elektron.
Hibridisasi ;
Orbital hibrida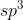 seharusnya memiliki bentuk tetrahedral, tetapi karena dalam molekul
seharusnya memiliki bentuk tetrahedral, tetapi karena dalam molekul 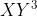 terdapat satu pasang elektron bebas, maka bentuk molekulnya menjadi segitiga piramida / piramida trigonal.
terdapat satu pasang elektron bebas, maka bentuk molekulnya menjadi segitiga piramida / piramida trigonal.
Jawaban : C
Soal 5
Orbital hibrida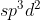 dimiliki oleh unsur dengan struktur elektron terluar . . . . .
dimiliki oleh unsur dengan struktur elektron terluar . . . . .
A.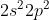
B.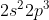
C.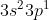
D.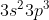
E.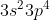
Pembahasan :
Orbital hibrida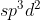 adalah penggabungan orbital s, 3 buah orbital p dan 2 buah orbital d yang tingkat energinya setara (nilai bilangan kuantumnya sama )
adalah penggabungan orbital s, 3 buah orbital p dan 2 buah orbital d yang tingkat energinya setara (nilai bilangan kuantumnya sama )
Untuk memiliki orbital hibrida maka minimal sebuah atom, mengisi elektronyaa sampai tingkat energi ketiga, karena pada tingkat ini sudah ada subkulit d. Untuk lebih jelasnya ingat kembali prinsip Aufbau dalam pengisian elektron.
1s tingkat energi 1
tingkat energi 1
2s 2p tingkat energi 2
2p tingkat energi 2
3s 3p 3d tingkat energi 3
3p 3d tingkat energi 3
Jika option A dan B tidak mungkin memiliki orbital hibrida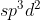 .
.
Kita tinggal mengecek option yang lain
Tidak mungkin membentuk orbital hibrida karena eksitasi hanya mungkin terjadi dari orbital 3s ke 3p membentuk orbital hibrida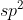 .
.
Atom dengan konfigurasi diatas juga tidak membentuk orbital hibrida karena eksitasi yang dilakukan orbital 3s ke 3d akan menghasilkan orbital hibrida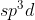 saja.
saja.
Jawaban : E
Soal 6
Pernyatan berikut yang mendukung bahwa pada molekul terdapat orbital hibrida
terdapat orbital hibrida 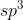 adalah . . . .
adalah . . . .
A. Bentuk molekulnya linier
B. Sifat kepolaran molekul \
\
C. Adanya sepasang elektron bebas
D. Adanya 2 elektron tunggal pada oksigen
E. adanya 3 pasang elektron ikatan yang energinya sama
Pembahasan :
Molekul memiliki orbital
memiliki orbital 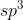
Konfigurasi elektron
H (nomor atom 1) =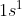
O (nomor atom 8) =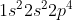
Atom pusat = O
Kedaan dasar
Karena sudah tersedia 2 orbital yang berisi elektron tidak berpasangan, maka atom O dalam molekul tidak mengalami eksitasi elektron, tetapi langsng pada proses hibridisasi.
tidak mengalami eksitasi elektron, tetapi langsng pada proses hibridisasi.
Orbital hibrida =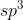
Bentuk molekul = sudut (karena punya dua pasangan elektron bebas)
Terdapat dua pasang elektron ikatan yang digunakan bersama dengan atom H.
Kepolaran = Polar (karena bentuk molekul yang asimetri)
Jawaban : B
B.
C.
D.
E.
Pembahasan :
Molekul
Konfigurasi elektron :
X (nomor atom 15) =
Y (nomor atom 9 ) =
Keadaan dasar (atom X)
Atom X mengalami hibridisasi tanpa meaui proses eksitasi elektron.
Hibridisasi ;
Orbital hibrida
Jawaban : C
Soal 5
Orbital hibrida
A.
B.
C.
D.
E.
Pembahasan :
Orbital hibrida
Untuk memiliki orbital hibrida maka minimal sebuah atom, mengisi elektronyaa sampai tingkat energi ketiga, karena pada tingkat ini sudah ada subkulit d. Untuk lebih jelasnya ingat kembali prinsip Aufbau dalam pengisian elektron.
1s
2s
3s
Jika option A dan B tidak mungkin memiliki orbital hibrida
Kita tinggal mengecek option yang lain
Tidak mungkin membentuk orbital hibrida karena eksitasi hanya mungkin terjadi dari orbital 3s ke 3p membentuk orbital hibrida
Atom dengan konfigurasi diatas juga tidak membentuk orbital hibrida karena eksitasi yang dilakukan orbital 3s ke 3d akan menghasilkan orbital hibrida
Jawaban : E
Soal 6
Pernyatan berikut yang mendukung bahwa pada molekul
A. Bentuk molekulnya linier
B. Sifat kepolaran molekul
C. Adanya sepasang elektron bebas
D. Adanya 2 elektron tunggal pada oksigen
E. adanya 3 pasang elektron ikatan yang energinya sama
Pembahasan :
Molekul
Konfigurasi elektron
H (nomor atom 1) =
O (nomor atom 8) =
Atom pusat = O
Kedaan dasar
Karena sudah tersedia 2 orbital yang berisi elektron tidak berpasangan, maka atom O dalam molekul
Orbital hibrida =
Bentuk molekul = sudut (karena punya dua pasangan elektron bebas)
Terdapat dua pasang elektron ikatan yang digunakan bersama dengan atom H.
Kepolaran = Polar (karena bentuk molekul yang asimetri)
Jawaban : B



















No comments:
Post a Comment