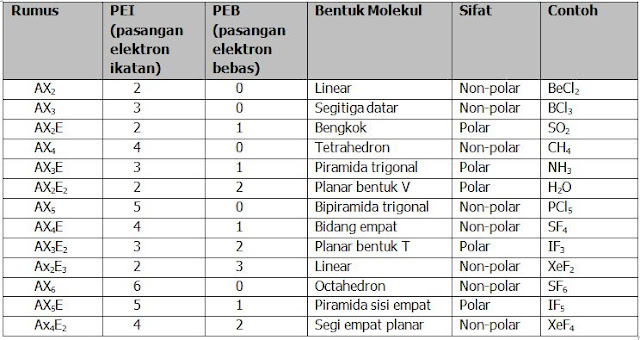
Sebelum membahas soal tentang geometri molekul berdasarkan teori domain elektron, ada baiknya teman teman membaca terlebih dahulu materi singkat tentang cara menentukan bentuk molekul menggunakan teori domain elektronberikut ini . Kemudian saya juga akan menyajikan tabel hubungan PEB dan PEI terhadap bentuk molekul dan kepolaran senyawa, karena kita akan menggunakannya dalam menjawab soal, sebagai berikut :
Menentukan jumlah domain elektron (Pasangan elektron ikatan (PEI) dan pasangan elektron bebas(PEB)) suatu molekul
Soal 1
Molekul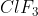 mempunyai bentuk T. Jumlah pasangan elektron ikatan dan pasangan elektron bebas berturut - turut adalah . . . . .
mempunyai bentuk T. Jumlah pasangan elektron ikatan dan pasangan elektron bebas berturut - turut adalah . . . . .
A. 2 dan 2
B. 3 dan 2
C. 4 dan 0
D. 4 dan 1
E. 5 dan 1
Pembahasan :
Ada beberapa cara untuk menentukan jumlah PEB dan PEI suatu molekul :
Cara 1
Dengan melihat tabel hubungan PEI dan PEB terhadap bentuk molekul (syarat : tentu kalian harus punya tabelnya, kemudian jika tidak boleh menggunakan tabel kalian harus hafal tidak hanya tipe molekul senyawa, tetapi juga jumlah domainnya, disamping kalian juga harus menghafal bentuk molekulnya)
Berdasatkan tabel bentuk T planar / datar memiliki jumlah pasangan elektron ikatan = 3, dan pasangan elektron bebasnya = 2
Cara 2
Menggambar Struktur Lewis (jika diketahui nomor atomnya, atau kalian bisa melihat tabel perodik untuk memperoleh data nomor atomnya)
Cl ( nomor atom 17) = 2 8 7 Jumlah elektron valensi = 7
Jumlah elektron valensi = 7
F ( nomor atom 9) = 2 7 Jumlah elektron valensi = 7
Jumlah elektron valensi = 7
Atom pusat = Cl ( jumlahnya paling sedikit)
Atom F dengan Cl akan berikatan tunggal karena F hanya butuh satu elektron lagi untuk mencapai kestabilan sesuai aturan oktet, sehingga bentuk struktur lewisnya adalah :
Dari struktur lewis diatas, terlihat ada 3 pasangan elektron ikatan dan 2 buah pasangan elektron bebas.
Cara 3
(cara termudah menurut saya, syarat = diketahui nomor atom )
Cl ( nomor atom 17) = 2 8 7 Jumlah elektron valensi = 7
Jumlah elektron valensi = 7
F ( nomor atom 9) = 2 7 Jumlah elektron valensi = 7
Jumlah elektron valensi = 7
Atom pusat = Cl
X atau PEI = 3 ( lihat saja jumlah subtituen yang terikat pada atom pusat, karena pada molekul terikat 3 buah atom F pada atom pusat Cl, maka jumlah PEI-nya adalah 3)
Jumlah elektron ikatan = 3 (karena jenis ikatan kovalen yang terjadi antara F dan Cl adalah tunggal, sehingga dibutuhkan 3 buah elektron Cl untuk berikatan dengan 3 buah atom F)
E atau PEB =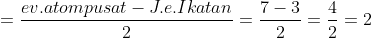
Jawaban : B
Menentukan bentuk molekul suatu senyawa netral
Soal 2
Senyawa dibawah ini yang mempunyai bentuk molekul seperti gambar dibawah ini adalah . . . .(nomor atom : H = 1, Te = 52, C = 6, Cl = 17, I = 53, Xe = 54 dan Al = 13)
A.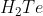
B.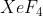
C.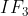
D.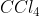
E.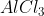
Pembahasan :
Gambar molekul diatas adalah bentuk molekul tetrahedral dengan tipe molekul adalah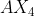 . Untuk mencari mana senyawa yang mempunyai tipe molekul , cukup melihat jumlah subtituen yang terikat pada atom pusat.
. Untuk mencari mana senyawa yang mempunyai tipe molekul , cukup melihat jumlah subtituen yang terikat pada atom pusat.
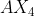
Ada 4 buah atom yang terikat pada atom pusat dan tidak mepunyai pasangan elektron bebas.
Berdasarkan hal tersebut, kemungkinan jawaban hanya dua yaitu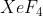 dan
dan 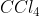 . Untuk memastikan yang benar, kita perlu mencari bentuk molekul masing masing senyawa .
. Untuk memastikan yang benar, kita perlu mencari bentuk molekul masing masing senyawa .
Senyawa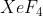
Xe (nomor atom 54 ) = 2 8 18 18 8 Jumlah elektron valensi = 8
Jumlah elektron valensi = 8
F (nomor atom 9) = 2 7 Jumlah elektron valensi = 7
Jumlah elektron valensi = 7
Atom pusat = Xe (jumlahnya paling sedikit)
X atau PEI = 4 (jumlah F yang terikat pada atom Xe)
Jumlah elektron ikatan = 4 (karena ikatan F dengan Xe tunggal, sehingga dibutuhkan 4 elektron Xe untuk berikatan tunggal dengan 4 atom F)
E atau PEB =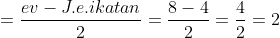
Tipe molekul =
Bentuk moleku = Segiempat datar
Senyawa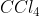
C (nomor atom 6 ) = 2 4 jumlah elektron valensi = 4
jumlah elektron valensi = 4
Cl (nomor atom 17) 2 8 7 jumlah elektron valensi = 7
jumlah elektron valensi = 7
Atom pusat = C
X atau PEI = 4 ( jumlah subtituen Cl pada atom pusat C)
Jumlah elektron ikatan = 4 (karena ikatan antara Cl dengan C adalah kovalen tunggal)
E atau PEB =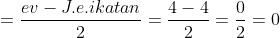
Tipe molekul =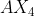
Bentuk molekul = Tetrahedral
Jawaban : D
Menentukan Bentuk Molekul Suatu Ion Poliatomik
Soal 3
Ion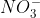 merupakan ion poliatomik. Atom N bertindak sebagai atom pusat. Bentuk molekul ion
merupakan ion poliatomik. Atom N bertindak sebagai atom pusat. Bentuk molekul ion 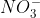 yaitu . . . .
yaitu . . . .
A. Tetrahedral
B. Oktahedral
C. Trigonal bipiramida
D. Bentuk T
E. Segitiga datar
Pembahasan :
Ion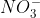 adalah ion poliatomik. Untuk menentukan bentuk molekunya ikutilah langkah - langkah berikut :
adalah ion poliatomik. Untuk menentukan bentuk molekunya ikutilah langkah - langkah berikut :
Konfigurasi elektron ;
N (nomor atom 7) = 2 5 Jumlah elektron valensi = 5
O (nomor atom 8) = 2 6 Jumlah elektron valensi = 6
Atom pusat = N
Atom ujung = O
Langkah 1 : Menghitung jumlah pasangan elektron
Rumus =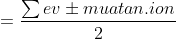
Tanda berlaku jika ion positif = - dan jika ion negatif maka +
Untuk ion jumlah pasangan elektron
=+(3&space;x&space;ev&space;O)+Muatan.Ion}{2}=&space;\frac{(1x5)+(3x6)+1}{2}=&space;\frac{24}{2}=&space;12)
Langkah 2 : Menghitung PEI atom pusat
PEI = Jumlah atom - 1
Jumlah atom pada ion adalah = 4 (1 buah atom N dan 3 buah atom O)
PEI untuk ion = 4 - 1 = 3
Langkah 3 : Menghitung jumlah pasangan elektron atom pusat
Pasangan elektron atom pusat = jumlah pasangan elektron yang berada di sekitar atom pusat
Pasangan elektron atom pusat
= Pasangan elektron - (3 x Jumlah atom ujung)
= 12 - ( 3 x 3)
= 12 - 9
= 3
Jumlah Jumlah atom ujung ditujukan untuk semua atom kecuali ato H karena pada atom H hanya memiliki satu buah elektron, dan jika sudah berikatan dengan atom lai, maka tidak ada lagi elektron disekeliling atom.
Langkah 4 : Menghitung PEB
PEB = Pasangan elektron pusat - PEI = 3 - 3 = 0
Langkah 5 : Menentukan Tipe dan Bentuk Molekul
Tipe molekul =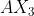
Bentuk molekul = Segitiga datar / Trigonal planar
Jawaban : E
Menentukan Notasi VSEPR suatu molekul
Soal 4
Notasi VSEPR untuk molekul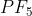 adalah . . . .(nomor atom P = 15 dan F = 9)
adalah . . . .(nomor atom P = 15 dan F = 9)
A.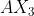
B.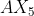
C.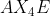
D.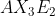
E.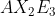
Pembahasan :
Notasi VSEPR =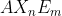
Konfigurasi elektron penyusun molekul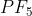 :
:
P (Nomor atom 15 ) = 2 8 5 jumlah elektron valensi = 5
jumlah elektron valensi = 5
F (nomor atom 9 ) = 2 7 jumlah elektron valensi = 7
jumlah elektron valensi = 7
Atom pusat = P (jumlah paling sedikit)
X atau PEI = 5 (Jumlah subtituen / atom yang terikat pada atom pusat)
Jumlah elektron ikatan = 5 ( Karena untuk berikatan tunggal dengan 5 atom F dibutuhkan 5 buah elektron atom pusat P)
E atau PEB =
Tipe molekul = Notasi VSEPR =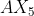
Jawaban : B
Menjelaskan kenapa terjadi perbedaan sudut ikatan dalam suatu molekul
Soal 5
Dalam molekul air terdapat sudut ikatan sebesar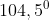 . Sudut ini lebih kecil dibandingkan sudut tetrahedral (
. Sudut ini lebih kecil dibandingkan sudut tetrahedral (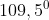 ) .Hal ini disebabkan oleh . . . . .
) .Hal ini disebabkan oleh . . . . .
A. Gaya tolak PEB > PEI
B. Gaya tolak PEB = PEI
C. Gaya tolak PEB < PEI
D. Molekul air memiliki 4 pasang elektron
E. Ukuran atom oksigen lebih besar dibandingkan atom Hidrogen
Pembahasan :
Molekul air harusnya memiliki sudut ikatan tetrahedral (karena mempunyai 4 domain) sebesar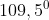 , tetapi kenyataannya hanya
, tetapi kenyataannya hanya 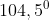 .
.
Hal ini dapat dijelaskan sebagai berikut :
Jumlah domain elektron dalam molekul ada 4 buah, terdiri dari dua pasangan elektron ikatan (ikatan dengan H) dan dua pasang elektotron bebas (karena untuk berikatan dengan dua atom H hanya dibutuhkan 2 elektron atom O, sehingga tersisa 4 elektron atau 2 pasang elektron yang tidak digunakan dalam berikatan ).
ada 4 buah, terdiri dari dua pasangan elektron ikatan (ikatan dengan H) dan dua pasang elektotron bebas (karena untuk berikatan dengan dua atom H hanya dibutuhkan 2 elektron atom O, sehingga tersisa 4 elektron atau 2 pasang elektron yang tidak digunakan dalam berikatan ).
Catatan : Konfigurasi elektron
H (nomor atom 1)= 1 Jumlah elektron valensi = 1
Jumlah elektron valensi = 1
O (Nomor atom 8)= 2 6 jumlah elektron valensi = 6
jumlah elektron valensi = 6
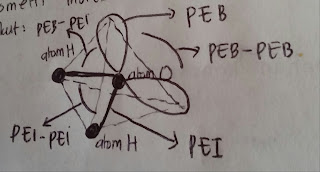
Jika kita gambarkan bentuk geometri molekul adalah sebagai berikut :
adalah sebagai berikut :
Ada 3 jenis tolakan pada molekul yaitu PEB - PEI, PEB - PEB dan PEI - PEI. Kita ketahui bahwa tolakan terbesar terjadi antara PEB - PEB, sehingga tolakan ini akan mendorong ikatan lain sedemikian rupa sehingga sudut ikatannnya mengecil sampai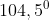 dengan tujuan meminimalkan tolakan.
dengan tujuan meminimalkan tolakan.
Jawaban : A
Menentukan bentuk molekul senyawa berdasarkan konfigurasi / nomor atom penyusun suatu molekul
Soal 6
Konfigurasi elektron :
N =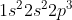
Cl =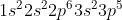
Bentuk molekul dari senyawa yang terjadi jika kedua unsur tersebut berikatan sesuai aturan oktet adalah . . . .
A. Linier
B. Segitiga piramida
C. Tetrahedral
D. Segitiga bipiramida
E. Oktahedral
Pembahasan :
Konfigurasi elektron :
N =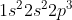
Kulit valensi =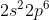
Jumlah Elektron Valensi = 2 + 3 = 5
Cl =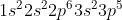
Kulit Valensi =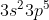
Jumlah elektron valensi = 2 + 5 = 7
Pada soal soal sebelumnya selaui diberikan rumus molekul senuawa yang akan ditentukan bentuk molekulnya, tetapi soal ini tidak. Jadi langkah pertama yang harus dilakukan adalah menentukan rumus molekul senyawa yang terjadi.
N dengan ev = 5, membutuhkan 3 buah elektron lagi agar stabil sesuai dengan aturan oktet, maka ia akan berikatan tunggal dengan 3 buah atom Cl (karena ev atom Cl = 7). Sehingga rumus molekul senyawa yang terjadi adalah .
Atom pusat = N
X atau PEI = 3
Jumlah elektron ikatan = 3
E atau PEB =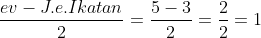
Tipe molekul =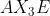
Bentuk molekul =Segitiga Bipiramida/Piramida Trigonal
Jawaban : D
Soal 7
Jika atom X(nomor atom 4) dan Y(nomor atom 17) berikatan, bentuk molekul dan sifat kepolaran yang terbentuk adalah . . . .
A. Segiempat planar dan polar
B. Linier dan polar
C. Tetrahedral dan Non polar
D. Oktahedral dan non polar
E. Linier dan nonpolar
Pembahasan :
X(nomor atom 4) = 2 2 Jumlah elektron valensi = 2
Jumlah elektron valensi = 2
Y(nomor atom 17) = 2 8 7 Jumlah elektron valensi = 7
Jumlah elektron valensi = 7
Jika X dan Y berikatan maka akan mebentuk molekul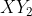 . Kenapa??
. Kenapa??
Kita lihat dari atom Y yang memiliki ev = 7, hanya mungkin mebentuk ikatan kovalen tunggal karena hanya mebutuhkan 1 buah elektron lagi agar stabil secara oktet. Karena jumlah elektron valensi atom X hanya 2, berati ada dua ikatan kovaen tunggal antara X dan Y sehingga rumus molekulnya adalah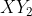 . Ini adalah meolekul yang menyimpang dari aturan oktet karena elektron disekitar atom pusat X tidak cukup 8.
. Ini adalah meolekul yang menyimpang dari aturan oktet karena elektron disekitar atom pusat X tidak cukup 8.
Molekul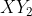
Atom pusat = X
X atau PEI = 2
Jumlah elektron ikatan = 2
E atau PEB =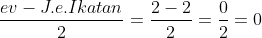
Tipe molekul =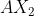
Bentuk molekul = Linier
Kepolaran = Non polar
Jawaban : E
Menentukan jumlah domain elektron (Pasangan elektron ikatan (PEI) dan pasangan elektron bebas(PEB)) suatu molekul
Soal 1
Molekul
A. 2 dan 2
B. 3 dan 2
C. 4 dan 0
D. 4 dan 1
E. 5 dan 1
Pembahasan :
Ada beberapa cara untuk menentukan jumlah PEB dan PEI suatu molekul :
Cara 1
Dengan melihat tabel hubungan PEI dan PEB terhadap bentuk molekul (syarat : tentu kalian harus punya tabelnya, kemudian jika tidak boleh menggunakan tabel kalian harus hafal tidak hanya tipe molekul senyawa, tetapi juga jumlah domainnya, disamping kalian juga harus menghafal bentuk molekulnya)
Berdasatkan tabel bentuk T planar / datar memiliki jumlah pasangan elektron ikatan = 3, dan pasangan elektron bebasnya = 2
Cara 2
Menggambar Struktur Lewis (jika diketahui nomor atomnya, atau kalian bisa melihat tabel perodik untuk memperoleh data nomor atomnya)
Cl ( nomor atom 17) = 2 8 7
F ( nomor atom 9) = 2 7
Atom pusat = Cl ( jumlahnya paling sedikit)
Atom F dengan Cl akan berikatan tunggal karena F hanya butuh satu elektron lagi untuk mencapai kestabilan sesuai aturan oktet, sehingga bentuk struktur lewisnya adalah :
Dari struktur lewis diatas, terlihat ada 3 pasangan elektron ikatan dan 2 buah pasangan elektron bebas.
Cara 3
(cara termudah menurut saya, syarat = diketahui nomor atom )
Cl ( nomor atom 17) = 2 8 7
F ( nomor atom 9) = 2 7
Atom pusat = Cl
X atau PEI = 3 ( lihat saja jumlah subtituen yang terikat pada atom pusat, karena pada molekul terikat 3 buah atom F pada atom pusat Cl, maka jumlah PEI-nya adalah 3)
Jumlah elektron ikatan = 3 (karena jenis ikatan kovalen yang terjadi antara F dan Cl adalah tunggal, sehingga dibutuhkan 3 buah elektron Cl untuk berikatan dengan 3 buah atom F)
E atau PEB =
Jawaban : B
Menentukan bentuk molekul suatu senyawa netral
Soal 2
Senyawa dibawah ini yang mempunyai bentuk molekul seperti gambar dibawah ini adalah . . . .(nomor atom : H = 1, Te = 52, C = 6, Cl = 17, I = 53, Xe = 54 dan Al = 13)
A.
B.
C.
D.
E.
Pembahasan :
Gambar molekul diatas adalah bentuk molekul tetrahedral dengan tipe molekul adalah
Ada 4 buah atom yang terikat pada atom pusat dan tidak mepunyai pasangan elektron bebas.
Berdasarkan hal tersebut, kemungkinan jawaban hanya dua yaitu
Senyawa
Xe (nomor atom 54 ) = 2 8 18 18 8
F (nomor atom 9) = 2 7
Atom pusat = Xe (jumlahnya paling sedikit)
X atau PEI = 4 (jumlah F yang terikat pada atom Xe)
Jumlah elektron ikatan = 4 (karena ikatan F dengan Xe tunggal, sehingga dibutuhkan 4 elektron Xe untuk berikatan tunggal dengan 4 atom F)
E atau PEB =
Tipe molekul =
Bentuk moleku = Segiempat datar
Senyawa
C (nomor atom 6 ) = 2 4
Cl (nomor atom 17) 2 8 7
Atom pusat = C
X atau PEI = 4 ( jumlah subtituen Cl pada atom pusat C)
Jumlah elektron ikatan = 4 (karena ikatan antara Cl dengan C adalah kovalen tunggal)
E atau PEB =
Tipe molekul =
Bentuk molekul = Tetrahedral
Jawaban : D
Menentukan Bentuk Molekul Suatu Ion Poliatomik
Soal 3
Ion
A. Tetrahedral
B. Oktahedral
C. Trigonal bipiramida
D. Bentuk T
E. Segitiga datar
Pembahasan :
Ion
Konfigurasi elektron ;
N (nomor atom 7) = 2 5 Jumlah elektron valensi = 5
O (nomor atom 8) = 2 6 Jumlah elektron valensi = 6
Atom pusat = N
Atom ujung = O
Langkah 1 : Menghitung jumlah pasangan elektron
Rumus =
Tanda berlaku jika ion positif = - dan jika ion negatif maka +
Untuk ion jumlah pasangan elektron
=
Langkah 2 : Menghitung PEI atom pusat
PEI = Jumlah atom - 1
Jumlah atom pada ion adalah = 4 (1 buah atom N dan 3 buah atom O)
PEI untuk ion = 4 - 1 = 3
Langkah 3 : Menghitung jumlah pasangan elektron atom pusat
Pasangan elektron atom pusat = jumlah pasangan elektron yang berada di sekitar atom pusat
Pasangan elektron atom pusat
= Pasangan elektron - (3 x Jumlah atom ujung)
= 12 - ( 3 x 3)
= 12 - 9
= 3
Jumlah Jumlah atom ujung ditujukan untuk semua atom kecuali ato H karena pada atom H hanya memiliki satu buah elektron, dan jika sudah berikatan dengan atom lai, maka tidak ada lagi elektron disekeliling atom.
Langkah 4 : Menghitung PEB
PEB = Pasangan elektron pusat - PEI = 3 - 3 = 0
Langkah 5 : Menentukan Tipe dan Bentuk Molekul
Tipe molekul =
Bentuk molekul = Segitiga datar / Trigonal planar
Jawaban : E
Menentukan Notasi VSEPR suatu molekul
Soal 4
Notasi VSEPR untuk molekul
A.
B.
C.
D.
E.
Pembahasan :
Notasi VSEPR =
Konfigurasi elektron penyusun molekul
P (Nomor atom 15 ) = 2 8 5
F (nomor atom 9 ) = 2 7
Atom pusat = P (jumlah paling sedikit)
X atau PEI = 5 (Jumlah subtituen / atom yang terikat pada atom pusat)
Jumlah elektron ikatan = 5 ( Karena untuk berikatan tunggal dengan 5 atom F dibutuhkan 5 buah elektron atom pusat P)
E atau PEB =
Tipe molekul = Notasi VSEPR =
Jawaban : B
Menjelaskan kenapa terjadi perbedaan sudut ikatan dalam suatu molekul
Soal 5
Dalam molekul air terdapat sudut ikatan sebesar
A. Gaya tolak PEB > PEI
B. Gaya tolak PEB = PEI
C. Gaya tolak PEB < PEI
D. Molekul air memiliki 4 pasang elektron
E. Ukuran atom oksigen lebih besar dibandingkan atom Hidrogen
Pembahasan :
Molekul air harusnya memiliki sudut ikatan tetrahedral (karena mempunyai 4 domain) sebesar
Hal ini dapat dijelaskan sebagai berikut :
Jumlah domain elektron dalam molekul
Catatan : Konfigurasi elektron
H (nomor atom 1)= 1
O (Nomor atom 8)= 2 6
Jika kita gambarkan bentuk geometri molekul
Ada 3 jenis tolakan pada molekul yaitu PEB - PEI, PEB - PEB dan PEI - PEI. Kita ketahui bahwa tolakan terbesar terjadi antara PEB - PEB, sehingga tolakan ini akan mendorong ikatan lain sedemikian rupa sehingga sudut ikatannnya mengecil sampai
Jawaban : A
Menentukan bentuk molekul senyawa berdasarkan konfigurasi / nomor atom penyusun suatu molekul
Soal 6
Konfigurasi elektron :
N =
Cl =
Bentuk molekul dari senyawa yang terjadi jika kedua unsur tersebut berikatan sesuai aturan oktet adalah . . . .
A. Linier
B. Segitiga piramida
C. Tetrahedral
D. Segitiga bipiramida
E. Oktahedral
Pembahasan :
Konfigurasi elektron :
N =
Kulit valensi =
Jumlah Elektron Valensi = 2 + 3 = 5
Cl =
Kulit Valensi =
Jumlah elektron valensi = 2 + 5 = 7
Pada soal soal sebelumnya selaui diberikan rumus molekul senuawa yang akan ditentukan bentuk molekulnya, tetapi soal ini tidak. Jadi langkah pertama yang harus dilakukan adalah menentukan rumus molekul senyawa yang terjadi.
N dengan ev = 5, membutuhkan 3 buah elektron lagi agar stabil sesuai dengan aturan oktet, maka ia akan berikatan tunggal dengan 3 buah atom Cl (karena ev atom Cl = 7). Sehingga rumus molekul senyawa yang terjadi adalah .
Atom pusat = N
X atau PEI = 3
Jumlah elektron ikatan = 3
E atau PEB =
Tipe molekul =
Bentuk molekul =Segitiga Bipiramida/Piramida Trigonal
Jawaban : D
Soal 7
Jika atom X(nomor atom 4) dan Y(nomor atom 17) berikatan, bentuk molekul dan sifat kepolaran yang terbentuk adalah . . . .
A. Segiempat planar dan polar
B. Linier dan polar
C. Tetrahedral dan Non polar
D. Oktahedral dan non polar
E. Linier dan nonpolar
Pembahasan :
X(nomor atom 4) = 2 2
Y(nomor atom 17) = 2 8 7
Jika X dan Y berikatan maka akan mebentuk molekul
Kita lihat dari atom Y yang memiliki ev = 7, hanya mungkin mebentuk ikatan kovalen tunggal karena hanya mebutuhkan 1 buah elektron lagi agar stabil secara oktet. Karena jumlah elektron valensi atom X hanya 2, berati ada dua ikatan kovaen tunggal antara X dan Y sehingga rumus molekulnya adalah
Molekul
Atom pusat = X
X atau PEI = 2
Jumlah elektron ikatan = 2
E atau PEB =
Tipe molekul =
Bentuk molekul = Linier
Kepolaran = Non polar
Jawaban : E




No comments:
Post a Comment