Sebelum memasuki perhitungan pH asam-basa yang terakhir, yaitu perhitungan pH campuran asam + basa, terlebih dahulu dalami dulu reaksi-reaksinya. Lah, biasanya kan reaksi di soal ada bang, tinggal disetarakan aja. Seenakmu ngomong begitu-_-. Di reaksi asam-basa kita dituntut untuk bisa menganalisis hasil reaksinya, karena bisa saja hasil reaksinya memiliki koefisien 2, 10, atau 3/2.
Ciri-ciri reaksi asam + basa:
- Reaksi asam-basa bisa digunakan senyawa asam kuat dan basa kuat, maupun asam lemah dan basa lemah
- Reaksi asam + asam tidak akan terjadi, begitu juga dengan reaksi basa + basa
- Reaksi asam + basa terjadi dengan perpindahan ion-ion di senyawa asam dan basa
- Hasil reaksinya berupa senyawa garam dan air
Ingat, bahwa reaksi asam-basa ini juga sangat penting untuk perhitungan pH selanjutnya, yaitu pH hidrolisis garam dan pH buffer. Jangan disepelekan, ya!
Nah, untuk memahami reaksi asam-basa ini, kalian harus kembali mengingat reaksi ionisasi! Perhatikan skema berikut!
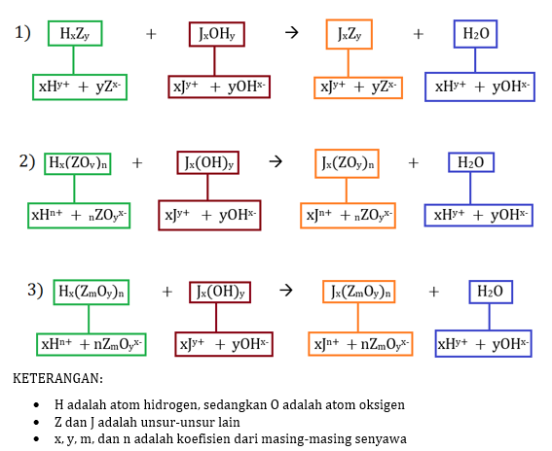
A. Reaksi asam + basa (reaksi penetralan)
Reaksi penetralan adalah reaksi yang menghasilkan air. Nah, di bawah ini adalah contoh-contoh reaksinya, baik spesi lemah maupun kuat:



B. Reaksi NH3 (amoniak) + asam
Reaksi amoniak dengan jenis asam lemah maupun kuat, menghasilkan suatu senyawa yang mengandung ion amonium (NH4+) atau garam amonium. So, reaksi ini hanya menghasilkan satu senyawa saja. Perhatikan contoh berikut! (Untuk memahami pembentukan pada produk, ingat kembali teori lewis)




No comments:
Post a Comment