Asam atau basa suatu zat kimia disebabkan oleh beberapa hal. Ratusan tahun yang lalu, para pakar kimia telah berhasil menemukan mengapa suatu zat dapat dikatakan asam, basa, atau netral! Dalam penemuan ini, Lavoisier mengatakan bahwa oksigen bukanlah sembarang nama unsur, karena dibalik nama “oksigen” berarti pembentukan asam. Label A hingga C berikut adalah para pakar kimia yang berhasil menemukan tuntas penentu sifat asam-basa:
A. Teori Arrehenius
Sebelum teori Arrehenius ditemukan, seperti yang dikatakan tulisan “merah” di atas bahwa Lavoisier mengidentifikasikan sifat asam terlebih dahulu. Lalu, seorang ahli kimia, Sir Humphry Day, menemukan bahwa hidrogen klorida tidak mengandung unsur oksigen tetapi bersifat asam, bahkan dikategorikan asam kuat; maka kesimpulan Lavoisier ditolak dalam dunia kimia.
Teori Arrehenius berpatokan pada reaksi ionisasi suatu senyawa kimia, ia menyatakan bahwa:
- Asam = zat yang menghasilkan/melepaskan ion hidrogen (H+) atau ion hidronium (H3O+)
- Basa = zat yang menghasilkan/melepaskan ion hidroksida (OH-)
Sebagai contoh:
- HCl –> H+ + Cl- (melepaskan ion hidrogen)
- NaOH –> Na+ + OH- (melepaskan ion hidroksida)
- Al(OH)3 –> Al3+ + 3OH- (melepaskan ion hidroksida)
- H3PO4 –> 3H+ + PO4 3- (melepaskan ion hidrogen)
B. Teori Bronsted-Lowry
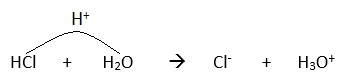
Teori Bronsted-Lowry muncul setelah adanya reaksi uji coba suatu zat dengan benzena dan zat lain. Ambil contoh asam klorida (HCl) dilarutkan dalam air, yang akan larut sempurna menghasilkan ion-ion baru. Namun, HCl yang lain dilarutkan dalam pelarut benzena (C6H6), nyatanya HCl mengendap sempurna atau tidak terjadi reaksi. Reaksi HCl dalam air terjadi ketika H2O menarik satu ion proton dari HCl seperti pada gambar di samping. Dalam teori Bronsted-Lowry, pelarut yang digunakan tidak terbatas pada air saja, bisa pelarut yang lain. Nah, Bronsted-Lowry menyatakan bahwa sifat asam-basa:
- Asam = pendonor (pemberi) proton (H+)
- Basa = akseptor (penerima) proton (H+)
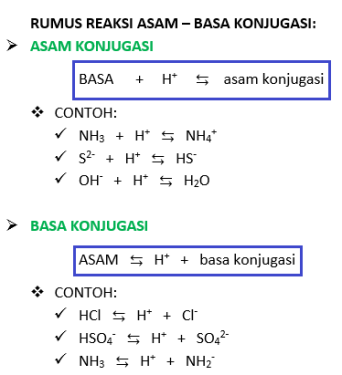
Dalam teori Bronsted-Lowry, dikenal adanya istilah “asam-basa konjugasi“, yaitu bentuk ion dari reaksi-reaksi Bronsted-Lowry. Istilah ini dikarenakan adanya donor dan akseptor proton (H+).
- Asam konjugasi = suatu senyawa di bagian produk (kanan) yang bertambah satu (1) atom hidrogennya (H) dari reaktan (kiri). Sifat di bagian reaktan adalah “basa”, tetapisifat di bagian produk adalah “asam”.
- Basa konjugasi = suatu senyawa di bagian produk (kanan) yang kehilangan satu (1) atom hidrogennya (H) dari reaktan (kiri). Sifat di bagian reaktan adalah “asam”, tetapisifat di bagian produk adalah “basa”.
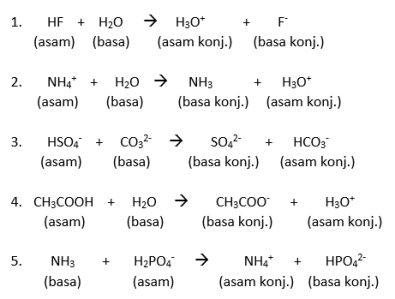
Di bawah ini adalah contoh dan rumus dari asam-basa konjugasi:
C. Teori Lewis

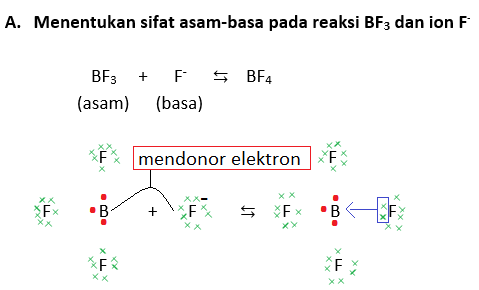
Teori Lewis adalah teori terbesar dari semua teori asam-basa, artinya teori Lewis sudah mencakup teori Arrhenius dan Bronsted-Lowry. Nah, coba perhatikand deh reaksi di bawah ini:
NH3 + HCl ⇆ NH4+ + Cl-
Jika dilihat dari teori Bronsted-Lowry, sudah ketahuan bahwa NH3 adalah basa sementara HCl adalah asam, lalu NH4+ adalah asam konjugasi, sedangkan Cl- adalah basa konjugasi. Namun, Lewis berbeda pendapat dengan konsep dari Bronsted-Lowry yang memakai donor-akseptor ion proton. Di sini, Lewis mengkonsepkan bahwa sifat suatu zat asam atau basa dilihat dari donor-akseptor elektronnya berdasarkan struktur Lewis.
Dalam reaksi antara amoniak dan HCl di atas, jelas terlihat bahwa HCl memberi ion proton ke amoniak, tetapi HCl juga bertindak sebagai penerima elektron dari amoniak (NH3) sebab dalam NH3 terdapat pasangan elektro bebas (PEB).
Sebagai kesimpulan:
- Asam = akseptor (penerima) pasangan elektron dan tidak mempunyai PEB
- Basa = donor (pemberi) pasangan elektron dan mempunyai PEB
Untuk memahaminya, perhatikan contoh-contoh berikut (ingat kembali juga ya tentang struktur Lewis yang dipelajari kelas 10 kemarin di bab ikatan kimia!):
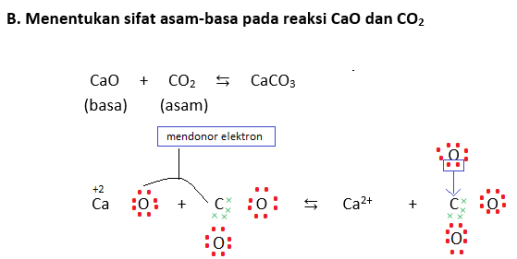
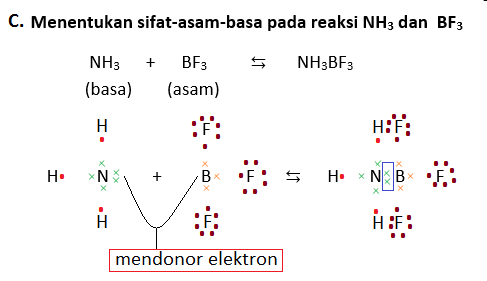
D. Reaksi ionisasi
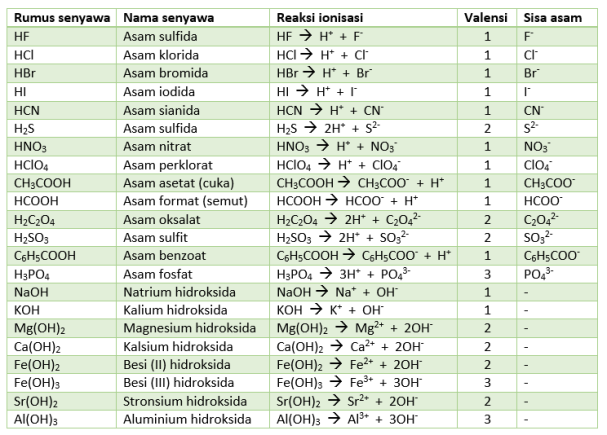
- Reaksi ionisasi = reaksi suatu senyawa yang memecahkan ion-ion yang terkandung dalam senyawa tersebut
- Valensi = banyaknya atom H+ (khusus asam) dan atom OH- (khusus basa) dalam reaksi ionisasi, yang digunakan dalam perhitungan kimia\
- Sisa asam = anion (ion negatif) yang terbentuk dari asam setelah melepaskan ion proton (H+)
- Asam hipotesis = asam yang tidak stabil dan akan terurai menjadi zat lain, seperti HNO2, H2SO3, dan H2CO3.
Nah, tabel di bawah ini menujukkan rumus dan contoh dari reaksi-reaksi ionisasi beserta keterangan lainnya:

CONTOH SOAL:
- Diketahui persamaan reaksi HCl + NH3 –> NH4Cl. Menurut Arrhenius, reaksi tersebut tidak dapat digolongkan reaksi asam-basa karena …
A. Tidak melibatkan transfer elektron
B. Zat yang dihasilkan bersifat netral
C. Tidak membentuk ion H+ dan OH-D. Tidak melibatkan transfer proton
E. Reaksi mengalami ionisasi
–> Pembahasan: Dalam pengertian asam-basa dalam teori Arrhenius berkaitan dengan ion H+ dan OH- serta reaksi ionisasi. Sementara reaksi di soal tidak mengalami reaksi ionisasi, so obsein E salah - Kelebihan teori Bronsted-Lowry yaitu dapat menjelaskan …
A. Reaksi ionisasi
B. Sifat asam-basa pada reaksi reversibel
C. Reaksi asam-basa dengan pelarut air saja
D. Reaksi asam-basa yang tidak melibatkan transfer proton
E. Reaksi asam-basa berdasarkan serah terima pasangan elektron - Perhatikan senyawa-senyawa berikut
1) Cl-
2) H2PO4 –
3) HSO4-
4) H2C2O4
5) H2S
Menurut teori Bronsted-Lowry, spesi yang bersifat amfoter adalah …
A. 1) dan 4)
B. 1) dan 5)
C. 2) dan 3)
D. 3) dan 4)
E. 4) dan 5)
–> Pembahasan:
- Reaksi CN- + air –> HCN + OH- terjadi saat natirum sianida (NaCN) larut dalam air akibat ion natrium memiliki potensi lebih besar terlepas dari air. Maka, pernyataan yang tepat mengenai reaksi tersebut adalah …
A. H2O merupakan asam
B. CN- merupakan asam
C. HCN merupakan basa konjugasi
D. OH- merupakan asam konjugasi
E. H2O dan HCN merupakan pasangan asam-basa konjugasi
–> Pembahasan: Silkana scroll ke atas tentang teori Bronsted-Lowry pada bagian asam-basa konjugasi untuk memahaminya. Yuk, latihan! - Menurut Arrhenius, H2O bersifat netral karena …
A. Bersifat nonpolar
B. H2O tidak berwarna
C. Merupakan pelarut universal
D. Molekul air tidak mudah teurai
E. Menghasilkan ion H+ dan OH- yang sama banyak
–> Pembahasan: Berdasarkan reaksi ionisasi air (H2O –> H+ + OH-), jumlah koefisien ion H+ dan OH- sama banyak, artinya bersifat netral - Diketahui reaksi kimia H2O + NH3 –> NH4+ + OH-. Pasangan yang merupakan asam-basa konjugasi adalah …
A. H2O dan OH-
B. H2O dan NH4+
C. H2O dan NH3
D. OH- dan NH3
E. NH4+ dan OH-
–> Pembahasan: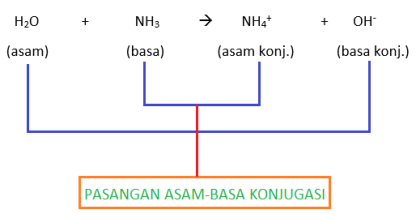



No comments:
Post a Comment