Asam amino adalah monomer (turunan asam karboksilat, yang mengandung gugus amina) dari protein.
A. Struktur Asam amino
- Mengandung gugus karboksil (—COOH)
- Mengandung gugus amina (—NH2)
- Struktur yang mengandung gugus amina terikat pada atom C alfa (α), yaitu atom C yang terikat pada gugus karboksil atau paling ujung
B. Asam amino esensial
Merupakan asam amino yang harus ada dalam makanan sehari-hari karena tubuh tidak dapat membuat atau menyintesis asam amino tersebut. Contoh asam amino esensial: valin (Val), leusin (Leu), isoleusin (Ile), fenilalanin (Phe), triptofan (Trp), treonin (Thr), metionin (Met), lisin (Lys), histidin (His), dan arginin (Arg).
C. Asam amino nonesensial
Yaitu asam amino yang tidak harus ada dalam makanan karena tubuh dapat membuat asam amino tersebut. Contohnya: glisin (Gly), alanin (Ala), asparagin (Asn), glutamin (Gln), prolin (Pro), serin (Ser), tirosin (Tyr), asam glutamat (Glu), sistein (Cys), asam aspartat (Asp), sistin (Cys-Cys), hidroksiprolin, hidroksilisin.
D. Sifat-sifat asam amino
- Amfoter = dapat bereaksi dengan asam maupun basa, yang dipengaruhi oleh gugus karboksil (asam) dan amina (basa). Namun, apabila suatu asam amino mengikat lebih dari satu gugus —COOH dan satu gugus amina, maka bersifat asam (ex = asam aspartat dan asam glutamat. Dan, apabila suatu asam amino mengikat satu gugus karboksil dan lebih dari satu gugus amina, maka bersifat basa (ex = arginin, lisis, dan histidin)
- Optis aktif = semua asam amino (kecuali glisin) mempunyai optis aktif yaitu atom C asimetris yang bersifat kiral dengan mengikat empat gugus yang berbeda. Oleh karena itu, semua asam amino (kecuali glisin) bersifat dapat memutar bidang polarisasi cahaya
E. Ion zwitter
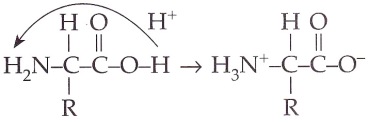
Ion zwitter adalah reaksi asam-basa intramolekul antarmolekul asam amino membentuk inbipolar. Bentuk asam aminonya yang dominan bergantung pada pH larutan, yaitu:
- Dalam larutan asam kuat, semua asam amino membentuk kation
- Dalam larutan basa kuat, asam amino membentuk anion
- Jika bersifat netral dengan syarat konsentrasi kation sama dengan anion, maka ion bipolar maksimum
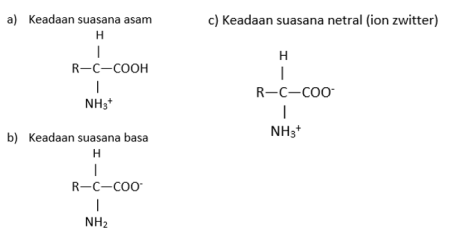
F. Titik isoelektrik ion zwitter
Titik isoelektrik adalah keadaan di mana ion zwitter bersifat netral. Tiap-tiap asam amino mempunyai titik isoelektrik (TIE) yang berbeda-beda, dari 6,1 hingga menyentuh 10,8. Titik isoelektrik ini berguna untuk menyeimbangkan struktur asam amino saat disintesis.
- Jika pH asam (di bawah 7), maka TIE menunjukkan ke ion kation, yaitu —NH2
- Jika pH basa (di atas 7), maka TIE menunjukkan ke ion anion, yaitu —COO
- Jika pH netral (sama dengan 7), maka TIE menunjukkan ion zwitter
Gambar di bawah ini menunjukkan bagaimana suatu asam amino terbentuk pada suasana pH, termasuk ke dalam ion zwitter:
G. Struktur dan sifat-sifat protein
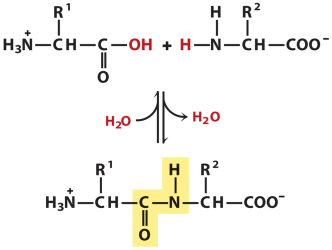
Protein (polipeptida) adalah polimer dari asam amino yang berikatan peptida. Ikatan peptida adalah ikatan yang terjadi antara atom C dengan N dan O, N dengan H, dan C dengan O, yang menghubungkan monomer-monimer asam amino. Berikut sifat-sifat protein:
- Membentuk ion zwitter dalam air
- Dapat mengalami denaturasi (kerusakan struktur).
- Dapat dihidrolisis menjadi asam amino dengan asam encer atau enzim protease
- Jika dilarutkan dalam air, mempunyai viskositas (kekentalan) lebih besar daripada air
- Bersifar koloid hidrofil
H. Denaturasi protein
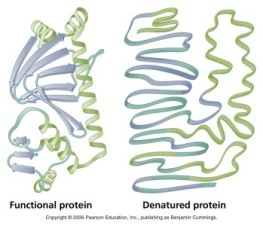
Denaturasi protein adalah berubahnya struktur protein dari struktur asalnya. Denaturasi protien sangat mudah terjadi terhadap pemanasan, perubahan pH, gerakan mekanik, tercampur dalam ion logam dan pelarut organik. Pada peristiwa ini, struktur protein yang rusak adalah struktur kuaterner, tersier, atau sekunder; bergantung pada tingkat penyebab kerusakannya. Namun, struktur primer tetap utuh. Salah satu tanda bahwa protein rusak adalah adanya endapan atau penggumpalan protein (koagulasi; sifat koloid)
I. Uji keberadaan protein
- Reaksi Biuret = membuktikan adanya ikatan peptida menggunakan tetes senyawa CuSO4 encer dan NaOH, ditandai berwarna merah dan ungu.
- Reaksi Xantoprotein = membuktikan adanya inti benzena dalam protein menggunakan pemanasan protein dicampur asam nitrat pekat, ditandai warna kuning. Contoh: fenilalanin, triptofon, dan tirosin
- Reaksi Millon = membuktikan adanya gugus fenil (sejenis benzena) dalam proteinmenggunakan pemanasan protein ditambah merkuri nitrat (Hg(NO3)2), kemudian ditambah asam nitrit. Uji ini ditandai dengan warna merah berbentuk cincin
- Reaksi Belerang = membuktikan adanya gugus belerang dalam protien karena beracun. Uji ini menggunakan reaksi protein dengan NaOH, lalu dipanaskan dengan senyawa yang mengandung timbal seperti Pb(CH3COOH)2 dan Pb(NO3)2. Lalu, akan muncul endapan hitam dari PbS pada hasil reaksi. Contoh: sistein dan metionin
- Reaksi Sakaguchi = membuktikan adanya gugus guanidin (atom C yang mengikat N2 dengan ikatan tunggal dan mengikat N dengan ikatan ganda).Uji ini dibuktikan dengan sampel protein ditambah pereaksi Sakaguchi (naftol + natrium hipobromit), menghasilkan warna merah
- Reaksi Hopkins-Cole = membuktikan adanya gugus indol dala protein menggunakan penambahan asam sulfat (H2SO4) ke dalam protein secara perlahan-lahan. Hasil reaksi menunjukkan lapisan di bawah larutan protein hingga terjadi pembentukkan cincin antara kedua lapisan



No comments:
Post a Comment