31.
Ø MATERI: SISTEM PERIODIK UNSUR
Ø Energi pengionan disebut juga energi ionisasi. Setiap
unsur bisa mengalami energi ionisasi berkali-kali, maka ada namanya tingkat energi pengionan.
Di dalam soal, energi
pengionan
berhenti hingga tingkat keenam,
belum tentu unsur tersebut berada pada golongan VIA. Gimana menentukannya?
Ø Begini,
untuk menentukan muatan suatu unsur berdasarkan energi ionisasi didasarkan
pada besarnya energi yang
dilepaskan unsur tersebut sebesar-besarnya sehingga mencapai kestabilan. Nah, mari periksa
satu per satu:
ü 1087
à
2353 (mempunyai potensi 1.266
energi)
ü 2353
à
4620 (mempunyai potensi 2.267 energi)
ü 4620
à
6223 (mempunyai potensi 1.603 energi)
ü 6223
à
37831 (mempunyai
potensi
31.608 energi)
ü 37831à 47277 (mempunyai
potensi 9.446 energi)
Ø Nah, terlihat dari kelima label di atas, potensi energi tertinggi berada dari
6223 menuju
37831. Artinya, dari
keadaan energi pengionan keempat
menuju energi pengionan
kelima memerlukan potensi (daya)
sebesar 31.608 energi. So, unsur tersebut berada pada golongan IV A karena energi pengionan pada tingkat keempat menunjukkan yang
tertinggi.
Ø JAWABAN:
B
32.
Ø MATERI: GEOMETRI MOLEKUL
Ø Soal nomor
32 sudah sangat familiar, toh keluar juga di UN, sering malah. Di soal telah diketahui bahwa senyawanya adalah X2Y, tinggal gambar struktur
lewisnya saja seperti
gambar di bawah ini: (tanda titik dan silang menunjukkan banyaknya elektron valensi
tiap
unsur)
ü 17X = 2
8 7 (elektron valensinya 7)
ü 8Y = 2
6 (elektron valensinya 6)
Ø Seperti pada gambar di atas, banyaknya PEI dan PEB adalah 2 pasang pada atom pusat.
So, rumus molekulnya adalah
AX2E2 atau bentuk V.
Ø JAWABAN:
C
33.
Ø MATERI: HUKUM-HUKUM DASAR KIMIA
Ø CARA 1
(dengan
mencari rumus
kimianya)
1. Mencari
massa klor dari persentase
keseluruhan massa dalam 100
gram
· 100%
= massa C + massa N + massa H + massa Cl
100% = 32% + 18,67% + 2,67% + massa
Cl massa Cl = 46,66% gram
2. Mencari perbandingan
mol tiap-tiap
unsur
· mol karbon (C)
= 32
gram/12 = 2,67 mol
· mol nitrogen (N)
= 18,67 gram/14 = 1,33
mol
· mol hidrogen
(H)
= 2,67 gram/1 = 2,67
mol
· mol klor
(Cl) = 46,66 gram/16
= 1,33 mol
3. Bandingkan seluruh mol hingga mendapatkan angka yang bulat
Ø mol C : mol
N : mol H : mol Cl
2,67 : 1,33
: 2,67
: 1,33 (bagi
1,33 dan bulatkan)
2
: 1 :
2
: 1
4. Rumus molekul senyawanya adalah
C2NH2Cl atau C2H2NCl
5. Terlihat hanya terdapat 1 atom klor pada rumus senyawa tersebut
6. Mencari
banyak molekul klor
Ø N = 6,02 x 1023 x mol x banyak atom
= 6,02 x 1023 x 2 mol x 1
= 12,04 x 1023 atom klor
34.
Ø CARA 2
(menggunakan konsep hukum Proust)
1. Untuk
mencari persentase
massa
suatu unsur dalam suatu senyawa bisa menggunakan
persentase hukum Proust
(hukum perbandingan tetap)
Ø % suatu
unsur = Ar
unsur tsb x banyaknya atom pada senyawa x 100%
Mr senyawa tsb
2. Karena mencari jumlah atom Cl, cari terlebih dahulu banyaknya atom Cl pada senyawa (tidak perlu
mencari
rumus senyawanya, ribet!)
Ø
% unsur Cl
= Ar Cl
x banyaknya atom Cl x 100%
Mr senyawa
46,66 % = 35 x banyaknya atom Cl x 100%
75
Banyaknya atom Cl = 0,9
= 1
atom klor
3. Masukkan
ke rumus jumlah atom (partikel)
Ø N =
6,02 x 1023 x mol x banyak atom
= 12,04
x 1023 atom klor
Nah, lebih
mudah yang mana? Hehe.
Ø JAWABAN: C
Ø MATERI: STOIKIOMETRI
Ø Setarakan reaksi pada soal:
· 2NH3 + CO2 à (NH2)2CO + H2O
Ø Hitung
mol amoniak (NH3) dan karbon dioksida (CO2):
· mol amoniak = 34
gram/17 = 2 mol
· mol karbon dioksida = 22 gram/44 = 0,5
mol
|
Ø Hitung massa urea, (NH2)2CO, menggunakan konsep MBS (Mula-mula, Bereaksi, Sisa)
· Tersisa urea sebanyak
0,5 mol, artinya terdapat 30 gram
urea!
Ø JAWABAN:
B
35
Ø MATERI: STOIKIOMETRI
Ø Soal ini selalu muncul pada seleksi Sipenmaru,
lalu UN, akhirnya SBMPTN. Di soal
ada kata kuncinya, yaitu “Jika pada keadaan ini 0,8 g gas CH4 memiliki volume 1,2 L.” Kenapa? Karena
dari sana
kita bisa mendapatkan Mr gas Y melalui perbandingan mol antara NO2 dengan CH4!
Ø Masih ingat, kan, bahwa dalam kondisi yang sama (maksudnya tekanan dan suhu),
perbandingan
molaritas sama (hukum Avogadro).
· molaritas NO2 = molaritas CH4
volume volume
16 L 1.2 L
mol NO2 = 0,67 mol
Ø Nah,
bandingkan koefisien
NO2 dengan gas Y
|
·
|
NO2
|
+
|
H2O
|
à X +
Y
|
|
|
0,67 mol
|
|
|
0,67 mol
|
· 0,67 mol gas Y seberat 20 gram, artinya Mr gas A adalah 29,85 atau 30.
Ø JAWABAN: C
36.
Ø MATERI: TERMOKIMIA
Ø Di dalam reaksi, koefisien
reaksi melambangkan
banyaknya mol dalam senyawa tersebut. Untuk menghitung energi ikatan C=C (ralat pada soal), diperlukan penghitungan energi rata-rata:
· Energi
ikatan
rata
= energi kiri – energi
kanan
-3120 kJ = [2(energi C2H6) + 7(energi
O2)] – [ 4(energi
CO2) + 6 (energi
air)]
-3120 kJ = [2(C=C) + 12(C—H) + 7(O=O)] – [8(C=O) + 12(H—O)]
-3120
kJ =
[2(C=C) + 12(360) + 7(490)] – [8(740) + 12(460)]
-3120 kJ = [2(C=C) + 4320
+ 3430] – [5920 + 5520]
-3120 kJ = 2(C=C)
-3690
C=C = 285 kJ
Ø JAWABAN:
D
37.
Ø MATERI: REAKSI
REDOKS
Ø Untuk
mendapatkan mol ion ClO3- bisa didapatkan dari persamaan reaksi redoks setengah reaksi dalam
suasana asam
dahulu, baru diubah ke suasana basa:
1. Pisahkan mana yang menjadi oksidasi
dan reduksi
· Oksidasi: Cl2 à ClO3-
· Reduksi: Cl2 à Cl-
2. Setarakan atom mana yang mengalami perubahan biloks, yaitu klor (Cl)
· Oksidasi: Cl2 à 2ClO3-
· Reduksi: Cl2 à 2Cl-
3. Tambahkan air pada ruas yang kekurangan oksigen (khusus suasana asam), jika tidak ada oksigen
pada reaksi,
jangan ditambahkan! Lalu,
setarakan atom oksigen!
· Oksidasi: Cl2 + 6H2O à 2ClO3-
· Reduksi: Cl2 à 2Cl-
4. Tambahkan ion proton (H+) pada bagian selain senyawa air ditempatkan tadi, lalu
setarakan atom hidrogennya
· Oksidasi: Cl2 + 6H2O à 2ClO3- + 12H+
· Reduksi: Cl2 à 2Cl-
5. Hitung banyaknya elektron yang diperlukan antara ruas kanan
dan kiri
· Oksidasi: Cl2 + 6H2O à 2ClO3- + 12H+ + 10e
· Reduksi: Cl2 + 2e à 2Cl-
6. Setarakan antara elektron oksidasi dan reduksi
agar dapat dicoret dan menghasilkan
reaksi
redoks yang setara
· Oksidasi: Cl2 + 6H2O à 2ClO3- + 12H+ + 10e
· Reduksi: Cl2 + 2e à 2Cl- (dikali 5)
· Reaksi
redoks setara (suasana asam):
6Cl2 + 6H2O à 2ClO3- + 10Cl- + 12H+
7. Tambahkan reaksi ionisasi air dan setarakan sesuai banyaknya koefisien
ion proton (H+) agar
ion proton (suasana
asam) dapat dicoret dan digantikan dengan suasana
basa
· Reaksi suasana asam: 6Cl2 + 6H2O à 2ClO3- + 10Cl- + 12H+
· Reaksi ionisasi air: 12H+ + 12OH- à 12H2O
· Reaksi suasana basa:
6Cl2 + 12OH- à 2ClO3- + 10Cl- + 6H2O
8. Reaksi suasana basanya adalah:
· 6Cl2 + 12OH- à 2ClO3- + 10Cl- + 6H2O
· Terlihat bahwa jika mol gas klor (Cl2) 1 mol dibandingkan dengan mol ClO3-
didapatkan
perbandingannya 2/6 atau 1/3
Ø JAWABAN:
B
38.
Ø MATERI: ELEKTROKIMIA
Ø Perhatikan dan baca
soalnya
baik-baik! “Sel elektrolisis”! So, dalam singkatannya,
elektrolisis memiliki
singkatan KNAP (Katode negatif, anode positif) dalam jenis kutubnya. Tetapi, baik sel eletkrolisis maupun sel
volta, singkatan KARAOS (Katode
reduksi, anode oksidasi) sangat dan selalu berlaku.
Di soal ini, arus 10 mA da
konsentrasi 0,1 M tidak diperlukan,
hanya menipu, dan malah memikirkan kita ke hukum Faraday. Ya, gak?
Ø So, yang ditanya spesi yang terbentuk pertama kali di katode!? Sudah pasti pada singkatan KARAOS yang
dipakai ; katode sebagai reduksi. Reduksi sendiri memiliki
potensial sel (E º) positif.
Artinya, jawabannya hanya unsur
tembaga.
Ø JAWABAN: C
 39.
39.
Ø MATERI: LAJU REAKSI
Ø Untuk mendapatkan laju pengurangan gas oksigen, cukup perbandingan koefisien saja.
Kenapa? Begini, laju reaksi sendiri
artinya adalah konsentrasi suatu zat terhadap waktu:
· Laju reaksi
= ± [suatu zat] /
waktu (detik)
Ø Artinya, laju reaksi berbanding lurus dengan konsentrasi suatu zat, namun berbanding
terbalik dengan
waktu. Maksudnya, apabila konsentrasi
zat
besar, lajunya juga besar.
Ø Konsentrasi juga diketahui dari jumlah mol per volume. So, konsentrasi berbanding lurus
dengan jumlah mol. Dan, jumlah
mol setara dengan koefisien
reaksi. Karena
laju reaksi berbanding
lurus dengan konsentrasi, artinya berbanding lurus juga dengan koefisien
reaksi.
· Laju reaksi = konsentrasi = jumlah
mol = koefisien reaksi
Ø Jadi,
setarakan dulu reaksinya:
· 2H2S + 3O2 à 2SO2 + 2H2O
Ø Karena yang
diketahui laju
pembentukan
gas
“SO2”, bandingkanlah koefisien SO2
dengan oksigen.
· 3 x 6
/ 2 = 9 mol/L s
Ø JAWABAN: B
40.
Ø MATERI: KESETIMBANGAN KIMIA
Ø Untuk soal kesetimbangan kali ini memakai tekanan, bukan konsentrasi! Tekanan awal
1 atm pada soal bisa kita langsung masukkan ke reaksi pada soal. Dan, pada label “B” di
|
bawah
ini misalkan saja tekanannya x (terserah,
mau
2x, 3x, dsb) pada gas
flour.
Ø Dikatakan dalam soal bahwa tekanan total gas saat setimbang (label S pada reaksi di atas)
adalah 1,75 atm. Jadi:
· Tekanan total = tekanan F2 + tekanan O2 + tekanan F2O
1,75 atm = 1-x + 1-0,5x
+ x x = 0,25 atm
Ø Jadi, tekanan parsial setiap
zat
pada keadaan setimbang adalah:
· P F2 = 1-x atm = 1-0,25 =
0,5 atm
· P O2 = 1-0,5x atm = 0,75 atm
· P F2O = x atm = 0,25
atm
Ø So, Kp reaksi adalah:
(P F2)2 (P O2)
Ø JAWABAN:
E
41
Ø
MATERI: SIFAT KOLIGATIF LARUTAN
Ø Di soal ada
2 buah larutan, yaitu (sebut saja) larutan A (KCl dan MgCl2) serta
larutan B (hanya glukosa). Kata kunci di soal adalah “... pada
suhu yang sama dengan larutan ...”. Artinya, suhu yang sama adalah perubahan penurunan titik beku larutan A sama dengan
larutan B! Dengan kata
lain, gunakan perbandingan penurunan titik beku!
Ø Sebelum mencari perbandingannya, ingat bahwa KCl dan MgCl2 adalah larutan elektrolit kuat yang
terdisosiasi sempurna (derajat ionisasi, α, sebesar 1), dan diperlukan faktor Van
Hoff:
· Faktor
Van
Hoff (i) KCl (KCl ⇆ K+ + Cl-)
= 1 + (n-1)α
= 1 + (2-1)1
= 2
· Faktor
Van
Hoff (i) MgCl2 (MgCl2 ⇆ Mg2+ + 2Cl-)
= 1 + (n-1)α
= 1 + (3-1)1
= 3
Ø Bandingkan ΔTfa (penurunan
titik
beku larutan A) dan ΔTfb (penurunan titik
beku B):
· ΔTfa = ΔTfb
(ΔTf KCl) + (ΔTf MgCl2) = ΔTf glukosa
(Kf x molal
KCl x i KCl) + (Kf
x molal MgCl2 x i MgCl2) = Kf x molal glukosa
(mol KCl x 1000 x 2) + (0,05 mol x 1000 x 3) = 90 gram x 1
kg air
500 500 18 mol KCl = 0,05 mol
· Dalam
0,05 mol KCl (Mr = 74)
terdapat
3,7 gram KCl
Ø JAWABAN:
B
42.
Ø MATERI: LARUTAN PENYANGGA (BUFFER)
Ø Cari terlebih dahulu mol HClO dan NaOH
· mol HClO
= 100 mL x 0,1 M =
10 mmol
· mol NaOH = 100 L x 0,05
M = 5 mmol
Ø
Hitung pH larutan dengan mereaksikan HClO dan NaOH
· HClO + NaOH à NaClO + H2O
|
M
|
10 mmol
|
5 mmol
|
-
|
-
|
|
B
|
-5 mmol
|
-5 mmol
|
+5 mmol
|
+5 mmol
|
|
S
|
5 mmol
|
-
|
5 mmol
|
5 mmol
|
· Tersisa HClO, NaClO, dan air sebanyak 5 mmol, artinya terjadi sistem larutan
penyangga (Buffer)!
· [H+] = Ka x mmol
HClO
mmol NaClO
= 2 x 10-8 x 5 mmol
5 mmol
= 2 x 10-8
pH = 8 –
log 2
Ø
JAWABAN: D
43.
Ø MATERI: ASAM-BASA
Ø Dalam asam-basa Bronsted-Lowry, dikenal
istilah
asam-basa konjugasi.
· Asam konjugasi = bertambah jumlah atom H dari senyawa semula (bersifat asam ;
namun senyawa semula bersifat basa)
· Basa konjuasi = berkurang jumlah atom H dari senyawa semula (bersifat basa ;
namun senyawa semula bersifat asam)
Ø Dari 3 reaksi
pada soal, bisa diperiksa:
· H3AsO4 + H2O ⇆ H2AsO4- + H3O+
(asam)
(basa)
(basa konj.)
(asam konj.)
· HCO3- + H2O ⇆ CO32- + H3O+
(asam)
(basa) (basa konj.) (asam
konj.)
· S2- + H2O ⇆ HS- + OH-
(basa) (asam) (asam
konj.) (basa konj.)
Ø JAWABAN:
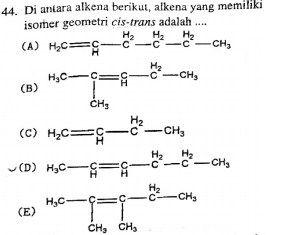
44
.
Ø MATERI: KIMIA
HIDROKARBON
Ø Isomer cis-trans digambarkan sejajar (satu garis lurus mendatar; cis) dan saling
menyilang (trans), tapi tidak digambarkan sebaris (satu garis
tegak lurus). Untuk memahami pengertian
ini, lihat obsein A sampai E pada gambar
berikut:
-JENIS
REAKSI KIMIA
Ø Jenis-jenis reaksi
pada soal:
· Reaksi eliminasi = reaksi penambahan
ikatan rangkap, artinya
ikatan tunggal
menjadi ikatan
rangkap dua; atau
dengan istilah:
“dari miskin ke kaya.”
· Reaksi adisi = reaksi pemutusan ikatan rangkap dibantu
hidrogen, artinya ikatan
rangkap dua
menjadi ikatan tunggal; atau dengan
istilah: “dari
kaya ke miskin.”
· Reaksi substitusi = reaksi pada dua senyawa, yang salah satu senyawa berpindah
posisi menghasilkan dua
zat yang baru
juga.
· Reaksi hidrolisis = reaksi suatu zat kimia
yang pasti sebelah reaktan
“hanya”
melibatkan air
(H2O).
· Reaksi kondensasi = reaksi penggabungan dua senyawa dengan cara menguapkan atau
dipanaskan, menghasilkan zat yang lebih
besar.
Ø JAWABAN:
B

#SBMPTN2016



















artikelnya sangat menarik kawan.. http://aromaessen.com
ReplyDelete