BAB 1
MATERI
MENENTUKAN KADAR ZAT DALAM CAMPURAN
1. PROSENTASE MASSA
2. PROSENTASE VOLUME
3. BAGIAN PER SEJUTA / bpj ( Part Per Million / ppm ) MASSA
4. BAGIAN PER SEJUTA / bpj ( Part Per Million / ppm ) VOLUME
PERUBAHAN MATERI
1. PERUBAHAN FISIKA
► Tidak terjadi perubahan permanen pada susunan zat dan jenis zat, yang berubah hanya sifat fisiknya saja.
2. PERUBAHAN KIMIA
► Terjadi perubahan sifat : ada endapan, suhu berubah, ada gelembung gas, warna berubah.
► Terjadi perubahan susunan zat.
► Terbentuk zat baru dengan sifat yang sama sekali berbeda dengan sifat zat asalnya (perubahan sifat permanen).
BAB 2
ATOM dan STRUKTUR ATOM
JENIS ATOM
► Atom Netral = Atom yang tidak bermuatan listrik
► Kation = Atom bermuatan positif
► Anion = Atom bermuatan negatif
BILANGAN KUANTUM
Bilangan yang menentukan letak keberadaan elektron suatu atom.
a. Bilangan kuantum utama ( n )
menyatakan nomor kulit tempat terdapatnya elektron, jenisnya : K ( n = 1 ), L ( n = 2 ), M ( n = 3 ), N ( n = 4 ), dst.
b. Bilangan kuantum azimuth ( ℓ )
menyatakan sub kulit tempat terdapatnya elektron, jenisnya :
s = sharp
|
nilai ℓ = 0
|
d = diffuse
|
nilai ℓ =2
|
p =principal
|
nilai ℓ = 1
|
f = fundamental
|
nilai ℓ =3
|
Untuk n = 1
Untuk n = 2
|
Î Î
|
ℓ =0
ℓ =0
|
( sharp)( sharp)
|
Untuk n = 3
|
Î
|
ℓ =1
ℓ =0
|
( principal )
( sharp )
|
ℓ =1
|
( principal )
| ||
Untuk n = 4
|
Î
|
ℓ =2
ℓ =0
|
( diffuse )
( sharp )
|
ℓ =1
|
( principal )
| ||
ℓ =2
|
( diffuse )
| ||
ℓ =3
|
(fundamental)
|
c. Bilangan kuantum magnetik ( m )
menyatakan orbital tempat terdapatnya elektron, jenisnya :
d. Bilangan kuantum spin ( s )
menyatakan arah elektron dalam orbital.
Jenisnya : + ½ dan – ½ untuk setiap orbital ( setiap harga m )
MENENTUKAN LETAK ELEKTRON
Untuk menentukan letak elektron maka perlu mengikuti aturan-aturan tertentu yang sudah ditetapkan.
Aturan Aufbau : Elektron-elektron mengisi orbital dari tingkat energi terendah baru tingkat energi yang lebih tinggi
Aturan Hund : Elektron-elektron tidak membentuk pasangan elektron sebelum masing- masing orbital terisi sebuah elektron
Larangan Pauli : Tidak diperbolehkan di dalam atom terdapat elektron yang mempunyai keempat bilangan kuantum yang sama
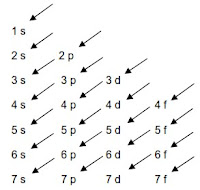
Diagram di bawah ini adalah cara untuk mempermudah menentukan tingkat energi orbital dari yang terendah ke yang lebih tinggi yaitu :
BAB 3
SISTEM PERIODIK UNSUR
Golongan Utama (Golongan A)
Golongan Transisi (Golongan B)
SIFAT PERIODIK UNSUR
Sifat unsur yang meliputi :
► Jari-jari atom
► Jari-jari kation
► Kebasaan
► Kelogaman
► Keelektropositifan
► Kereaktifan positif
Mempunyai kecenderungan seperti yang digambarkan di bawah ini :
Sedangkan sifat unsur yang meliputi :
► Potensial ionisasi ( energi ionisasi )
► Afinitas elektron
► Keasaman
► Kenon-logaman
► Keelektronegatifan ( maksimal di golongan VIIA )
► Kereaktifan negatif
► Keasaman oksi
Mempunyai kecenderungan seperti yang digambarkan di bawah ini :
BAB 4
IKATAN dan SENYAWA KIMIA
1. IKATAN ION ( IKATAN ELEKTROVALEN / HETEROPOLAR )
► Ikatan atom unsur logam (atom elektropositif) dengan atom unsur non logam (atom elektronegatif).
► Unsur logam melepas elektron dan memberikan elektronnya pada unsur non logam.
2. IKATAN KOVALEN ( HOMOPOLAR )
► Ikatan atom unsur non logam dengan atom unsur non logam.
► Pemakaian bersama elektron dari kedua unsur tersebut.
3. IKATAN KOVALEN KOORDINATIF(DATIV)
► Ikatan atom unsur non logam dengan atom unsur non logam.
► Pemakaian bersama elektron dari salah satu unsur.
4. IKATAN VAN DER WAALS
a. Gaya dispersi (gaya London)
► Terjadi gaya tarik menarik antara molekul-molekul non polar yg terkena aliran elektron (dipol sesaat) dengan molekul non polar disebelahnya yang terpengaruh (dipol terimbas) yang berdekatan.
► Gaya tarik antar molekulnya relatif lemah.
b. Gaya Tarik dipol
► Gaya tarik antara molekul-molekul kutub positif dengan kutub negatif.
► Gaya tarik antar molekulnya lebih kuat dari gaya tarik antara molekul dipol sesaat - dipol terimbas.
5. IKATAN HIDROGEN
► Terjadi antara atom H dari suatu molekul dengan atom F atau atom O atau atom N pada molekul lain.
► Ada perbedaan suhu tinggi dan sangat polar di antara molekul-molekulnya.
6. IKATAN LOGAM
► Ikatan ion logam dengan ion logam dengan bantuan kumpulan elektron sebagai pengikat atom-atom positif logam.
► Ikatannya membentuk kristal logam.
BENTUK GEOMETRI MOLEKUL
|
HIBRIDISASI
Proses pembentukan orbital karena adanya gabungan (peleburan) dua atau lebih orbital atom dalam suatu satuan atom.
Berbagai kemungkinan hibridisasi dan bentuk geometri orbital hibridanya sebagai berikut :
Orbital hibrida
|
Jumlah ikatan
|
Bentuk geometrik
|
sp
|
2
|
Linear
|
sp2
|
3
|
Segitiga datar samasisi
|
sp3
|
4
|
Tetrahedron
|
sp2d
|
4
|
Persegi datar
|
sp3d
|
5
|
Segitiga Bipiramidal
|
sp3d2
|
6
|
Oktahedron
|
|
SIFAT SENYAWA ION dan SENYAWA KOVALEN


















No comments:
Post a Comment