Nah kali ini kita semua akan belajar bagaimana caranya menjawab soal soal menghitung pH asam dan basa lemah. Tentu kalian yang kelas 11 SMA sudah akan belajar pokok bahasan ini. Mempelajarinya lebih dahulu akan membuat kalian unggul disekolah.
Soal 1
Asam lemah berikut yang termasuk asam lemah triprotik adalah . . . .
A. HF
B. HCN
C.
D.
E.
Pembahasan :
Asam lemah triprotik adalah asam lemah yang melepaskan 3 buah ion H+ dalam air. Uintuk menentukan mana asam yang triprotik adalah dengan melihat jumlah H yang dimiliki oleh asam tersebut dimana untuk asam yang megandung 3 buah atom H adalah asam tiprotik,
Nah dari penejelasan ini sudah diketahui bahwa asam lemah triprotik dari option soal diatas adalah .
.
Jawaban : E
Soal 2
Suatu asam lemah mempunyai harga tetapan ionisasi sebesar
mempunyai harga tetapan ionisasi sebesar  . Jika konsentrasi asam tersebut adalah 0,02 M, maka pH larutan asam tersebut adalah . . . .
. Jika konsentrasi asam tersebut adalah 0,02 M, maka pH larutan asam tersebut adalah . . . .
A. 2 - log 3
B. 3 - log 2
C. 4 - log 5
D. 4 - log 6
E. 5 - log 6
Pembahasan :
Yang diketahui adalah :
Tetapan ionisasi = Ka =
M asam lemah = 0,02 M = M
M
Rumus untuk mementukan konsentrasi H+ dari asam lemah :
![\small [H^{+}] = \sqrt{Ka \: x \: M}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{Ka&space;\:&space;x&space;\:&space;M})
![\small [H^{+}] = \sqrt{1,8 x 10^{-5} \: x \: 2 x 10^{-2}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{1,8&space;x&space;10^{-5}&space;\:&space;x&space;\:&space;2&space;x&space;10^{-2}})
![\small [H^{+}] = \sqrt{3,6 x 10^{-7}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{3,6&space;x&space;10^{-7}})
![\small [H^{+}] = \sqrt{36 x 10^{-8}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{36&space;x&space;10^{-8}})
![\small [H^{+}] = 6 x 10^{-4}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;6&space;x&space;10^{-4})
Setelah dapat [H+] barulah kita cari pH dengan menggunakan rumus :
pH = - log [H+]
= - log
= 4 - log 6
Jawaban : D
Soal 3
Tabel dibawah ini memperlihatkan harga Ka untuk 3 buah jenis asam lemah bervalensi satu.
No Nama Asam Konsentrasi Ka
1 Asam asetat 0,1 M
2. Asam benzoat 0,1 M
3. Asam fluorida 0,1 M
Berdasarkan data diatas, urutan kekuatan asam dari yang terlemah ditunjukkan oleh nomor . . . . .
A. 1 - 2 - 3
B. 1 - 3 - 2
C. 2 - 1 - 3
D. 3 - 1 - 2
E. 3 - 2 - 1
Pembahasan :
Misalkan saja ada suatu asam lemah HA yang mengion sebagai berikut :
HA(aq)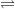 H+(aq) + A-(aq)
H+(aq) + A-(aq)
Maka rumus Ka nya dapat kita buat sebagai berikut :
![\small Ka = \frac{[H^{+}][A^{-}]}{[HA]}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;Ka&space;=&space;\frac{[H^{+}][A^{-}]}{[HA]})
Asam semakin kut ditandai dengan jumlah ion H+ yang dihasilkan semakin banyak. Untu asam lemah, masing masing asamnya menghasilkan ion H+ yang berbeda beda. Semakin banyak ion H+nya maka tentu semakin kuat asam lemah itu. Jika ion H+ yang dihasilkan semakin banyak maka reaksi kesetimbangan akan bergeser kearah pembentunkan ion H+ dan A- lebih banyak. Akibatnya adalah nilai Ka nya akan semakn besar.
Kesimpulan : Ka >>>> ==> Asam lemahnya semakin kuat
Nah untuk soal diatas urutan kekuatan asam dari yang terlemah adalah 3 - 2 - 1.
Jawaban : E
Soal 4
Suatu asam lemah HX dengan konsentrasi 0,1 M dan harga =
=  . Harga tetapan kesetimbangan dan konsentrasi ion H+ secara berturut turut adalah . . . . .
. Harga tetapan kesetimbangan dan konsentrasi ion H+ secara berturut turut adalah . . . . .
A.
B.
C.
D.
E.
Pembahasan :
Pertama kita cari dulu harga Ka jika diketahui alfa ( ) nya dengan menggunakan rumus :
) nya dengan menggunakan rumus :



^{2}\:&space;x\:&space;0,1)

Nah setelah itu baru kita dapat mencari harga konsentrasi ion H+ nya
![\small [H^{+}] = \sqrt{Ka \: x \: M}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{Ka&space;\:&space;x&space;\:&space;M})
![\small [H^{+}] = \sqrt{1 x 10^{-3}\: x \: 1 x 10^{-1}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{1&space;x&space;10^{-3}\:&space;x&space;\:&space;1&space;x&space;10^{-1}})
![\small [H^{+}] = \sqrt{1 x 10^{-4}}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;\sqrt{1&space;x&space;10^{-4}})
![\small [H^{+}] = 1 x 10^{-2}](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[H^{+}]&space;=&space;1&space;x&space;10^{-2}) M
M
Jawaban : C
Soal 5
Suatu basa emah NH4OH mempunyai konsentrasi 0,5 M dan terionisasi sebanyak 10%. Harga pOH dan pH secara berturut turut adalah . . . .
A. 1 - log 2 dan 13 + log 2
B. 2 - log 5 dan 12 + 1og 5
C. 3 - log 4 dan 11 + log 4
D. 4 - log 6 dan 10 + log 6
E. 5 - log 3 dan 9 + log 3
Pembahasan :
Jika NH4OH terionisasi sebanya 10 % maka nilai = 0,1.
= 0,1.
Ada dua cara mencari pOH dan pH nya yaitu dengan mencari Ka terlebih dahulu menggunakan rumus :

Atau langsung cari [H+] menggunakan rumus berikut :

Kita gunakan saja rumus kedua ini, karena lebih cepat.
![\small [OH^{-}] = M\: x \: \alpha](https://latex.codecogs.com/gif.latex?\dpi{100}&space;\small&space;[OH^{-}]&space;=&space;M\:&space;x&space;\:&space;\alpha)

=
pOH = - log [OH-]
= - log
= 2 - log 5
pH = 14 - pOH
= 14 - (2 - log 5)
= 12 + log 5
Jawaban : B
Soal 1
Asam lemah berikut yang termasuk asam lemah triprotik adalah . . . .
A. HF
B. HCN
C.
D.
E.
Pembahasan :
Asam lemah triprotik adalah asam lemah yang melepaskan 3 buah ion H+ dalam air. Uintuk menentukan mana asam yang triprotik adalah dengan melihat jumlah H yang dimiliki oleh asam tersebut dimana untuk asam yang megandung 3 buah atom H adalah asam tiprotik,
Nah dari penejelasan ini sudah diketahui bahwa asam lemah triprotik dari option soal diatas adalah
Jawaban : E
Soal 2
Suatu asam lemah
A. 2 - log 3
B. 3 - log 2
C. 4 - log 5
D. 4 - log 6
E. 5 - log 6
Pembahasan :
Yang diketahui adalah :
Tetapan ionisasi = Ka =
M asam lemah = 0,02 M =
Rumus untuk mementukan konsentrasi H+ dari asam lemah :
Setelah dapat [H+] barulah kita cari pH dengan menggunakan rumus :
pH = - log [H+]
= - log
= 4 - log 6
Jawaban : D
Soal 3
Tabel dibawah ini memperlihatkan harga Ka untuk 3 buah jenis asam lemah bervalensi satu.
No Nama Asam Konsentrasi Ka
1 Asam asetat 0,1 M
2. Asam benzoat 0,1 M
3. Asam fluorida 0,1 M
Berdasarkan data diatas, urutan kekuatan asam dari yang terlemah ditunjukkan oleh nomor . . . . .
A. 1 - 2 - 3
B. 1 - 3 - 2
C. 2 - 1 - 3
D. 3 - 1 - 2
E. 3 - 2 - 1
Pembahasan :
Misalkan saja ada suatu asam lemah HA yang mengion sebagai berikut :
HA(aq)
Maka rumus Ka nya dapat kita buat sebagai berikut :
Asam semakin kut ditandai dengan jumlah ion H+ yang dihasilkan semakin banyak. Untu asam lemah, masing masing asamnya menghasilkan ion H+ yang berbeda beda. Semakin banyak ion H+nya maka tentu semakin kuat asam lemah itu. Jika ion H+ yang dihasilkan semakin banyak maka reaksi kesetimbangan akan bergeser kearah pembentunkan ion H+ dan A- lebih banyak. Akibatnya adalah nilai Ka nya akan semakn besar.
Kesimpulan : Ka >>>> ==> Asam lemahnya semakin kuat
Nah untuk soal diatas urutan kekuatan asam dari yang terlemah adalah 3 - 2 - 1.
Jawaban : E
Soal 4
Suatu asam lemah HX dengan konsentrasi 0,1 M dan harga
A.
B.
C.
D.
E.
Pembahasan :
Pertama kita cari dulu harga Ka jika diketahui alfa (
Nah setelah itu baru kita dapat mencari harga konsentrasi ion H+ nya
Jawaban : C
Soal 5
Suatu basa emah NH4OH mempunyai konsentrasi 0,5 M dan terionisasi sebanyak 10%. Harga pOH dan pH secara berturut turut adalah . . . .
A. 1 - log 2 dan 13 + log 2
B. 2 - log 5 dan 12 + 1og 5
C. 3 - log 4 dan 11 + log 4
D. 4 - log 6 dan 10 + log 6
E. 5 - log 3 dan 9 + log 3
Pembahasan :
Jika NH4OH terionisasi sebanya 10 % maka nilai
Ada dua cara mencari pOH dan pH nya yaitu dengan mencari Ka terlebih dahulu menggunakan rumus :
Atau langsung cari [H+] menggunakan rumus berikut :
Kita gunakan saja rumus kedua ini, karena lebih cepat.
=
pOH = - log [OH-]
= - log
= 2 - log 5
pH = 14 - pOH
= 14 - (2 - log 5)
= 12 + log 5
Jawaban : B




No comments:
Post a Comment