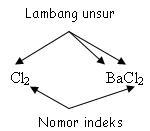
Rumus kimia menyatakan jenis dan jumlah atom dengan komposisi tertentu dari suatu zat. Rumus kimia terdiri dari lambang unsur dan nomor indeks.
Contoh :
Rumus kimia dibedakan menjadi :
1. Lambang Unsur
Rumus kimia unsur dinyatakan dengan lambang unsur. Contoh : Karbon = C, Hidrogen = H, Oksigen = O, dll.
2. Rumus Kimia Senyawa, terdiri dari :
a. Rumus Molekul
Molekul adalah partikel penyusun senyawa. Rumus molekul merupakan rumus yang menyatakan jenis dan jumlah atom yang membentuk suatu molekul senyawa tersebut.
Rumus molekul terdiri dari :
- Rumus Molekul Unsur, menyatakan gabungan atom-atom yang sama yang membentuk molekul. Contoh : O2, O3, H2, P4, S8.
- Rumus Molekul Senyawa, menyatakan gabungan dari beberapa atom yang berbeda. Contoh : CO2, H2O, NH3, HCl, dll.
Rumus empiris menyatakan perbandingan paling sederhana dari jumlah atom penyusun suatu molekul.
Nama Senyawa
|
Rumus Molekul
|
Rumus Empiris
|
Air
|
H2O
|
H2O
|
Asam Cuka
|
CH3COOH
|
CH2O
|
Glukosa
|
C6H12O6
|
CH2O
|
I. TATA NAMA SENYAWA ANORGANIK
1. Tata Nama Senyawa Biner
Senyawa biner adalah senyawa yang tersusun atas dua jenis atom. Berdasarkan jenis ikatannya, senyawa biner dapat dikelompokkan menjadi :
a. Senyawa Biner Ionik, terdiri atas suatu kation (ion logam) dan suatu anion (ion non logam).
Nama kation logam + ( anion non logam + -ida / -ide )
|
PbCl2 ( Timbal[II] klorida / Lead[II] chloride )
PbCl4 ( Timbal[IV] klorida / Lead[IV] chloride )
Untuk kation logam yang memiliki muatan lebih dari satu, muatannya ditulis dengan angka romawi dalam tanda kurung.
Daftar nama beberapa ion, baik kation maupun anion :
Kation Logam
|
Anion Non Logam
|
||
Kation
|
Nama
|
Anion
|
Nama
|
Li+
|
Litium |
H–
|
Hidrida / Hidride |
Na+
|
Natrium / Sodium |
N3-
|
Nitrida / Nitride |
K+
|
Kalium / Potassium |
O2-
|
Oksida / Oxide |
Mg2+
|
Magnesium |
P3-
|
Fosfida / Phosphide |
Ca2+
|
Kalsium |
S2-
|
Sulfida / Sulfide |
Ba2+
|
Barium |
Se2-
|
Selenida / Selenide |
Al3+
|
Aluminium |
F–
|
Fluorida / Fluoride |
Zn2+
|
Seng / Zinc |
Cl–
|
Klorida / Chloride |
Ag+
|
Perak / Silver |
Br–
|
Bromida / Bromide |
Ni2+
|
Nikel |
I–
|
Iodida / Iodide |
Sn2+
|
Timah (II) / Tin (II) |
Si4-
|
Silikida / Silicide |
Sn4+
|
Timah (IV) / Tin (IV) |
As3-
|
Aresenida / Arsenide |
Pb2+
|
Timbel (II) / Lead (II) |
Te2-
|
Tellurida / Telluride |
Pb4+
|
Timbel (IV) / Lead (IV) | ||
Fe2+
|
Besi (II) / Iron (II) | ||
Fe3+
|
Besi (III) / Iron (III) | ||
Cu+
|
Tembaga (I) / Copper (I) | ||
Cu2+
|
Tembaga (II) / Copper (II) | ||
Hg+
|
Raksa (I) / Mercury (I) | ||
Hg2+
|
Raksa (II) / Mercury (II) | ||
Pt2+
|
Platina (II) / Platinum (II) | ||
Pt4+
|
Platina (IV) / Platinum (IV) | ||
Au+
|
Emas ( I) / Gold (I) | ||
Au3+
|
Emas ( III) / Gold (III) | ||
Aturan penamaan senyawa kovalen adalah sebagai berikut :
- Penulisan unsur pertama pada senyawa kovalen mengikuti urutan berikut :
Contoh : Air, H2O bukan OH2 , Amonia, NH3 bukan H3N
( Nama Yunani jumlah atom unsur ke-1 ) ( nama unsur ke-1 ) + ( nama Yunani jumlah unsur ke-2 ) ( nama unsur
ke-2 + ida/ide ). |
- Nama jumlah atom dalam bahasa Yunani :
Ket : Jika jumlah atom unsur ke-1 hanya 1, tidak perlu ditambahkan awalan mono.
Contoh : NO2 ( Nitrogen Dioksida / Nitrogen Dioxide )
P2O5 ( Difosfor pentaoksida / Diphosphor pentaoxide)
2. Tata Nama Senyawa Poliatomik
Senyawa poliatom dibentuk oleh dua atom atau lebih yang berbeda.
Nama kation + Nama anion
|
Daftar ion poliatomik :
Ion Poliatomik
|
Nama Ion Poliatomik
|
NH4+
|
Amonium |
OH–
|
Hidroksida/Hidroxide |
CO32-
|
Karbonat/Carbonate |
CH3COO–
|
Asetat/Acetate |
CN–
OCN–
SCN–
|
Sianida/CyanideSianat/CyanateTiosianat/Thiocyanate |
C2O42-
|
Oksalat/Oxalate |
BrO–
BrO3–
BrO4–
|
Hipobromit/HypobromiteBromat/BromatePerbromat/Perbromate |
IO–
IO3–
IO4–
|
Hipoiodit/HypoioditeIodat/IodatePeriodat/Periodate |
SO32-
SO42-
|
Sulfit/SulfiteSulfat/Sulfate |
S2O32-
|
Tiosulfat/Thiosulfate |
SbO33-
SbO43-
|
Antimonit/AntimoniteAntimonat/Antimonate |
SiO32-
|
Silikat/Silicate |
NO2–
N03–
|
Nitrit/NitriteNitrat/Nitrate |
ClO–
ClO2–
ClO3–
ClO4–
|
Hipoklorit/HypocloriteKlorit/CloriteKlorat/CloratePerklorat/Perclorate |
MnO42-
MnO4–
|
Manganat/ManganatePermanganat/Permanganate |
AsO33-
AsO43-
|
Arsenit/ArseniteArsenat/Arsenate |
CrO42-
Cr2O72-
|
Kromat/chromateDikromat/dichromate |
PO33-
PO43-
|
Fosfit/PhosphiteFosfat/Phosphate |
MgSO4 : Magnesium sulfat (Senyawa dengan kation logam dan anion poliatomik)
NH4Cl : Amonium klorida (Senyawa dengan kation poliatomik dan anion nonlogam)
NH4NO3 : Amonium nitrat (Senyawa dengan kation poliatomik dan anion poliatomik)
3. Tata Nama Senyawa TernerSenyawa terner sederhana meliputi asam, basa, dan garam. Reaksi asam dengan basa menghasilkan garam.
a. Tata Nama Senyawa Asam
Asam adalah senyawa yang melepaskan ion H+ dalam air. Senyawa asam terdiri atas :
- Molekul Biner ( atom hidrogen dengan atom non logam)
Asam + (Nama atom non logam + ida )
|
(Hydro)Nama atom non logam(+ic) + acid
|
- Molekul Poliatomik ( atom hydrogen dengan anion poliatomik )
Asam + Nama anion poliatomik
|
Nama anion poliatomik* + acid
*jika ion poliatomik mengandung atom O, ganti akhiran –ate dengan -ic dan akhiran –ite diganti dengan –ous
|
H3PO3 ( Asam fosfit / Phosphorous acid)
b. Tata Nama Senyawa Basa
Kation logam + hidroksida
|
Kation logam + hydroxide
|
Mg(OH)2 ( Magnesium hidroksida / Magnesium hydroxide)
4. Tata Nama Senyawa Hidrat
Nama senyawa + nama yunani jumlah hidrat
|
Contoh : CuSO4 . 5H2O
II. TATA NAMA SENYAWA ORGANIK
Senyawa organik adalah senyawa-senyawa karbon dengan sifat-sifat tertentu. Senyawa organic memiliki tata nama khusus. Selain nama sistematis, banyak senyawa organic mempunya nama dagang (nama trivial). Beberapa diantaranya adalah :
- CH4 : Metana (gas alam)
- CO(NH2)2 : Urea
- CH3COOH : Asam cuka (asam asetat)
- C6H12O6 : Glukosa (gula darah, gula anggur)
- C12H22O11 : Sukrosa (gula tebu)
- HCHO : Formaldehida (bahan formalin)
- CHCl3 : Kloroform (bahan pembius)
- CHI3 : Iodoform (suatu antiseptic)
- CH3CH2OH : Etanol (alkohol)
- CH3COCH3 : Aseton (pembersih kuteks)
1) Pengertian
Reaksi kimia mengubah zat-zat asal (pereaksi = reaktan) menjadi zat-zat baru (produk). Misalnya reaksi gas hidrogen dengan gas oksigen membentuk air. Suatu reaksi kimia dinyatakan dengan menuliskan zat-zat yang terlibat dalam reaksi yang menggunakan pemaparan rumus-rumus kimia dalam bentuk persamaan reaksi.
Contoh:
Dengan keterangan:
Tanda panah : arah reaksi dibaca ‘membentuk’
(huruf kecil miring) : keadaan zat
Huruf g berarti gas, l (liquid) berarti cairan, s(solid) berarti padatan dan aq(aques) berarti larutan dalam air.
Koefisien reaksi :
bilangan yang mendahului rumus kimia zat dalam persamaan reaksi.
Menyatakan perbandingan parikel zat yang terlibat dalam reaksi.
Persamaan reaksi yang sudah diberi koefisien yang sesuai disebut ‘persamaan setara’.Dalam suatu reaksi, terjadi perubahan komposisi atom-atom penyusun zat. Berdasarkan hukum kekelan massa (jumlah zat sebelum dan sesudah reaksi adalah sama), maka dilakukan penyetaraan reaksi untuk memenuhi hukum kekekalan massa.
2) Menuliskan Persamaan Reaksi
Penulisan persamaan reaksi dapat dilakukan dalam tiga langkah:
- Menuliskan persamaan kata-kata yang terdiri dari nama dan keadaan zat pereaksi serta nama dan keadaan zat hasil reaksi
- Menuliskan persamaan rumus kimia zat pereaksi dan zat hasil reaksi, lengkap dengan wujud/keadaannya
- Menyetarakan yaitu memberi koefisien yang sesuai sehingga jumlah atom setiap unsur sama pada kedua ruas
Tulis persamaan reaksi setara dari pembakaran gas metana (CH4) dengan gas oksigen (O2) yang membentuk gas karbon dioksida (CO2) dan uap air (H2O)
Jawab:
Langkah 1 : menuliskan persamaan kata-kata
Langkah 2 : menuliskan persamaan rumus
Langkah 3: penyetaraan
3) Penyetaraan Persamaan Reaksi
Pada reaksi kimia atom-atom mengalami penataan ulang, tetapi jenis dan jumlah atom sebelum dan sesudah reaksi adalah sama. Untuk menyamakan jenis dan jumlah atom tersebut maka reaksi perlu disetarakan yaitu dengan memberi koefisien yang tepat. Banyak dilakukan dengan cara menebak, sebagai pemulaan dengan langkah:
- Tetapkan koefisien salah satu zat yang paling rumit, sama dengan 1 sedangkan zat lain diberi koefisien sementara dengan huruf
- Setarakan terlebih dahulu unsur yang terkait langsung dengan zat yang telah diberi koefisien 1 tadi.
- Setarakan unsur lainnya.
Tuliskan persamaan reaksi yang setara untuk reaksi berikut ini!
Jawab:
Langkah 1: persamaan reaksi tersebut
Langkah 2: Penyetaraan
1. Tetapkan koefisien NaOH = 1 sedangkan yang lain dengan huruf
2. Setarakan jumlah atom sejenis pada ruas kanan dan ruas kiri
Na : 1 = b + c (1)
O : 1 = 3c + d (2)
H : 1 = 2d (3)
Cl : 2a = b + c (4)
Dengan menggunakan model subtitusi dan
eliminasi maka dapat diperoleh dengan bilangan bulat: a = 3, b = 5, c =
1, d = 3. Persamaan reaksinya menjadi:


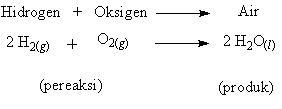
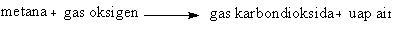

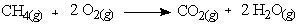
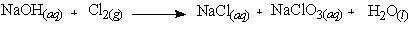
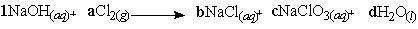
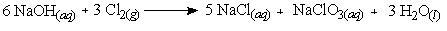


No comments:
Post a Comment