A. Istilah-istilah dan Satuan dalam Termokimia
a. Istilah-istilah dalam Termokimia
- Entalpi : energi yang terkandung dalam suatu zat dengan lambing H
- Energi : kemampuan suatu materi untuk melakukan kerja.
- Energi dalam : jumlah energi dari semua energi yang dimiliki oleh sistem molekul.
Energi dalam bernilai positif jika : sistem menyerap atau menerima panas atau sistem menerima kerja.
Energi dalam bernilai negatif jika : sistem melepaskan panas atau sistem melakukankerja.
Energi dalam tidak dapat diukur, yang dapat diukur hanya perubahan energinya yang dinyatakan sebagai ∆E.
∆E = EProduk – EReaktan
- Kalor (q) : energi yang berpindah dari sistem ke lingkungan atau sebaliknya dikarenakan perbedaan suhu di antara keduanya.
Q = m.c.∆T atau Q = C.∆T
- Kerja
: bentuk energi yang diperlukan dan dapat dinyatakan sebagai gaya yang bekerja melalui suatu jarak tertentu.
Kerja bernilai positif jika sistem menerima kerja.
Kerja bernilai negatif jika sistem melakukan kerja.
b. Satuan dalam Termokimia- 1 kJ = 1000 J
- 1 Kalori = 4,184 J
- 1 kKal = 1000 Kal
- 1 Liter atm = 10,12 Joule
Hukum kekekalan energi “Energi tidak dapat
diciptakan atau dimusnahkan. Energi dapat diubah dari suatu bentuk
energi menjadi bentuk lain”.
Contoh: batu baterai, dimana mengubah
energi kimia menjadi energi listrik yang kemudian listrik dapat dirubah
kebentuk lain seperti energi cahaya dalam senter.
Terjadinya perpindahan energi pada sistem dan lingkungan dapat digambarkan :
- Bahan bakar bereaksi dengan gas oksigen maka akan menimbulkan panas disekelilingnya. Pada proses ini terjadi perpindahan energi dari sistem ke lingkungan.
- Daun menyerap karbon dioksida yang kemudian bereaksi dengan air membentuk karbohidrat dan gas oksigen. Pada proses ini terjadi perpindahan energi dari lingkungan ke sistem.
Maka :
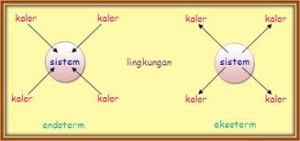
Sistem : segala sesuatu yang menjadi pusat perhatian atau perubahan energinya. Dalam kimia, yaitu sejumlah zat yang bereaksi.
Lingkungan : segala sesuatu yang berada di
sekeliling sistem. Dalam kimia, segala sesuatu di luar zat tersebut
seperti tabung reaksi.
C. Hubungan Energi Dalam, Kalor, dan Kerja dengan Hukum Termokimia
∆E (J) = q (J) + w (J)
Entalpi (H) adalah besarnya kalor reaksi yang diukur pada tekanan tetap
∆H = ∆HP– ∆HR
D. Sistem & Lingkungan
Terbagi atas tiga yaitu :
- Sistem terbuka : sistem yang memungkinkan terjadinya pertukaran kalor dan materi antara sistem dan lingkungan.
- Sistem tertutup : sistem yang memungkinkan terjadinya pertukaran kalor antara sistem dan lingkungan tetapi tidak terjadi pertukaran materi.
- Sistem terisolasi : sistem yang tidak memungkinkan terjadinya pertukaran kalor dan materi antara sistem dan lingkungan.
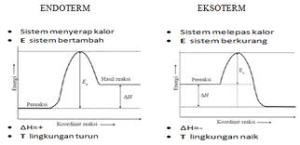
- Reaksi Eksoterm : reaksi yang melepaskan kalor atau menghasilkan energi.
Hakhir < Hawal
Hakhir – Hawal < 0
H berharga negatif (-)
- Reaksi Endoterm : reaksi yang menyerap kalor atau menerima energi
Hakhir > Hawal
Hakhir – Hawal > 0
H berharga positif (+)
F. Persamaan Termokimia
Contoh:
- Pada pembentukan 1 mol air dari gas hydrogen dan gas oksigen pada 25oC (298 K), 1 atm, dilepaskan kalor sebesar 286 kJ.
H2(g) + ½ O2(g) → H2O ∆H = -286 kJ
2H2(g) + O2(g) → 2H2O ∆H = – 572 kJ
- Reaksi karbon dan gas hydrogen membentuk 1 mol C2H2 pada temperature 25oC dan tekanan 1 atm memerlukan kalor sebesar 226,7 kJ
2C(s) + H2(g) → C2H2 ∆H = +226,7 kJ
Apabila pengukuran ∆H dilakukan untuk 1 mol zat pada kondisi standar, maka ∆H sama dengan entalpi molar dengan satuan kJ/mol.
G. Perubahan Entalpi Standar (∆Ho)
1. Perubahan entalpi pembentukan standar (∆Hof)
: perubahan entalpi yang terjadi pada pembentukan 1 mol zat dari
unsur-unsurnya diukur pada keadaan standar. Biasanya bersifat Endoterm.
UNSUR → SENYAWA
Contoh :
Ag(s) + ½ Cl2(g) → AgCl2(s) ∆Hof = – 127 kJ/mol
K(s) + Mn(s) + 2O2(g) → KMnO4 ∆Hof = – 813 kJ/mol
2. Perubahan entalpi penguraian standar (∆Hod)
: perubahan entalpi yang terjadi pada penguraian 1 mol zat menjadi
unsur-unsurnya diukur pada keadaan standar. Biasanya bersifat Eksoterm.
SENYAWA → UNSUR
Contoh :
AgCl2(s) → Ag(s) + ½ Cl2(g) ∆Hof = + 127 kJ/mol
KMnO4→ K(s) + Mn(s) + 2O2(g) ∆Hof = + 813 kJ/mol
3. Perubahan entalpi pembakaran standar (∆Hoc) : perubahan entalpi yang terjadi pada pembakaran 1 mol unsur atau senyawa diukur pada keadaan standar. Bersifat Eksoterm.
SYARAT : BEREAKSI DENGAN OKSIGEN
Contoh :
CH4(g) + O2(g) → CO2(g) + 2H2O(g) ∆Hoc = – 889,5 kJ
C2H2(g) + O2(g) → 2CO2(g) + H2O(g) ∆Hoc = – 129,9 kJ
4. Perubahan entalpi netralisasi (∆Hon) : perubahan entalpi yang terjadi pada saat asam dengan basa baik tiap mol asam atau basa.
ASAM + BASA → H2O
Contoh :
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) ∆Hon = – 57,1 kJ
H. Penentuan ∆H Reaksi
1. Penetuan ∆H reaksi melalui eksperimen Þ Kalorimeter
Q = m.c.∆T dimana ∆H = – Q
Contoh :
1. Di dalam calorimeter terdapat zat yag
bereaksi secara endoterm. Reaksi tersebut menyebabkan 1 kg air terdapat
dalam Kalorimeter mengalami penurunan suhu 5oC. Tentukan kalor reaksi dari reaksi tersebut.
Q = m.c.∆T
= 1000 gr x 4,2 J.g-1.c-1 x 5oC
= 21000 J ≈ 21 kJ
2. 50 mL larutan HCl 1 M yang suhunya 22oC dicampurkan dengan 50 mL larutan NaOH 1 M yang suhuny 22oC. pada reaksi tersebut terjadi kenaikan suhu sampai 28,78oC. Tentukan entalpi netralisasi dan tulis persaman termokimianya.
Jumlah mol HCl = 50 mL x 1 M = 50 mmol ≈ 0,05 mol
Jumlah mol NaOh = 50 mL x 1 M = 50 mmol ≈ 0,05 mol
Volum larutan = volume air = 100 mL
Massa larutan = massa air = 100 mL x 1gr/ml = 100 gr
Suhu awal = 22oC
Q = m.c.∆T
= 100 gr. 4,2 J.g-1.c-1 x (28,78 – 22) oC
= 2885,4 J ≈ 2, 8854 kJ
∆H = – Q
= – 2,8854 kJ ≈ ∆Hn untuk 0,05 mol H2O
∆Hn untuk 1 mol H2O = – 57,71 kJ/mol
Persamaan termokimia :
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) ∆H = – 57,71 kJ
2. Penentuan perubahan entalpi berdasarkan entalpi pembentukan
∆Hreaksi = ∑∆Hproduk – ∑∆Hreaktan
Setiap unsur bebas memiliki harga entalpi = 0
Contoh :
Tentukan perubahan entalpi reaksi pembentukan C2H8, jika diketahui:
∆Hof C2H6 = – 84,7 kJ/mol
∆Hof CO2 = – 393,5 kJ/mol
∆Hof H2O = – 285,5 kJ/mol
Jawab :
C2H6 + 3 ½ O2 → 2CO2 + 3H2O
∆Hreaksi C2H6 = [ 2 x ∆Hof CO2 + 3 x ∆Hof H2O] – [∆Hof C2H6 + 3 ½ x ∆Hof O2]
= [2 x – 393,5 kJ/mol + 3 x – 285,5 kJ/mol] – [- 84,7 kJ/mol + 3½ x 0 kJ/mol]
= – 1559,7 kJ/mol
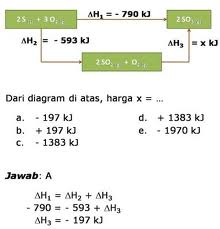
3. Penentuan perubahan entalpi berdasarkan Hukum Hess
Perubahan entalpi hana bergantung pada keadaan awal dan keadaan akhir reaksi
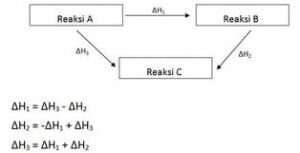
Contoh :
Þ Akibat pemutusan ikatan-ikatan kimia dan pembentukan ikatan kimia yang baru.
(Penerimaan energi) (Pembebasan energi)
Energi Ikatan Þ Jumlah energi yang diperlukan untuk memutuskan ikatan antar atom dalam 1 mol molekul berwujud gas.
∆Hreaksi = ∑energi ikatan yang diputuskan – ∑energi ikatan yang dibentuk
Contoh :
1. Hitunglah perubahan entalpi reaksi : CH4 + 4Cl2 → CCl4 + 4HCl. Jika diketahui : C – H = 415 kJ/mol; C – Cl = 330 kJ/mol; Cl – Cl = 243 kJ/mol; H – Cl = 432 kJ/mol
Jawab :
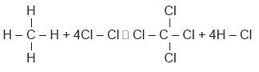
∆Hreaksi = ∑energi ikatan yang diputuskan – ∑energi ikatan yang dibentuk
= [ 4 C – H + 4 Cl – Cl ] – [ 4 C – Cl + 4 H – Cl]
= [ 4 (415) + 4 (243) ] – [ 4 (330) + 4 (432) ]
= 2632 – 3048 = – 416 kJ
2. Hitunglah energi ikatan rata-rata N – H dalam molekul NH3. Jika diketahui : ∆H NH3 = – 46,3 kJ, H – H = 436 kJ dan N ≡ N = 946 kJ
Jawab : N2 + 3H2 → 2NH3 ∆H = – 46,3 kJ
∆Hreaksi = ∑energi ikatan yang diputuskan – ∑energi ikatan yang dibentuk
-46,3 kJ = [ N ≡ N + 3 H – H ] – [ 2 ( 3 N – H) ]
-46,3 kJ = [ 946 + 3 (436) ] – [ 6 ( N – H ) ]
N – H = = 391,1 kJ

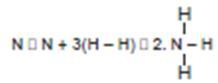


No comments:
Post a Comment