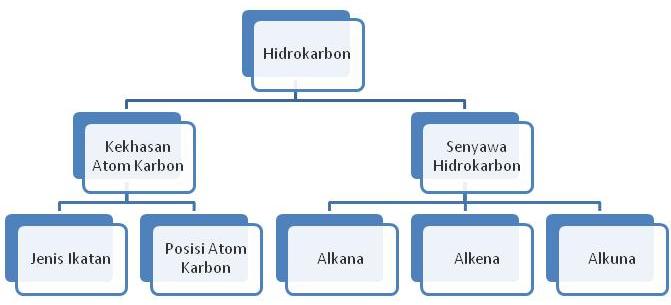
Kekhasan Atom Karbon
Atom karbon memiliki nomor atom 6 dengan konfigurasi elektron 6C : 1s2 2s2 2p2. Oleh karena memiliki 4 elektron pada kulit terluar, atom karbon dapat membentuk empat buah ikatan kovalen dengan atom-atom yang lain.
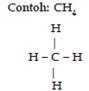
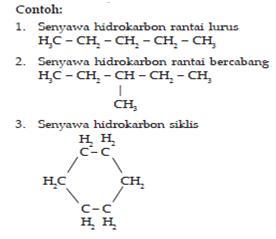
Atom karbon juga dapat berikatan dengan atom karbon yang lain membentuk rantai karbon. Ikatan atom karbon dengan atom karbon yang lain tersebut dapat membentuk rantai panjang lurus, bercabang, maupun melingkar membentuk senyawa siklis.
Jenis Ikatan Rantai Karbon
- Ikatan tunggal : H3C – CH3
- Ikatan rangkap dua : H2C = CH2
- Ikatan rangkap tiga : HC ≡ CH
- Atom C primer (1o) : atom C yang terikat pada satu atom C yang lain
- Atom C sekunder (2o) : atom C yang terikat pada dua atom C yang lain
- Atom C tersier (3o) : atom C yang terikat pada tiga atom C yang lain
- Atom C kuartener (4o) : atom C yang terikat pada empat atom C yang lain
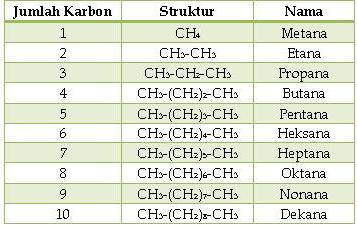
1. Alkana
Merupakan rantai karbon yang paling sederhana karena memiliki ikatan tunggal.
Rumus umum CnH2n+2
Tata nama alkana- Alkana rantai lurus : diberi nama sesuai dengan jumlah artom karbonnya yang terkadang ditambahkan normal (n) di depan nama alkana.
Contoh:
CH3 – CH2 – CH2 – CH3 n-butana atau butana
CH3 – CH2 – CH3 n-propana atau propana
1. Alkana siklis ( rantai tertutup) : diberi nama menurut banyakya atom karbon dalam cincin, dengan menambahkan awalan siklo-.
Contoh:
Siklobutana
2. Alkana bercabang ( memiliki rantai samping)
Terdapat beberapa aturan dalam penamaan rantai bercabang, yaitu :
1) Rantai terpanjang merupakan rantai utama.
2) Rantai utama diberi nomor mulai dari ujung rantai yang memiliki cabang.
3) Urutan penulisan nama : nomor cabang, naman cabang, nama rantai utama.
Nama senyawa di atas adalah 3-metil-pentana
4) Jika terdapat gugus metal pada atom C nomor 2, nama alkana diberi awalan iso.
Nama senyawa di atas adalah 3-metil-pentana
4) Jika terdapat gugus metal pada atom C nomor 2, nama alkana diberi awalan iso.
5) Jika alkana memiliki cabang lebih dari
satu, nama cabang digabung menjadi satu dan diberi awalan di- (jika
jumlah cabang dua), tri- (jika jumlah cabang 3), tetra- (jika jumlah
cabang 4).
6) Jika alkana memiliki cabang yang berbeda, penulisan nama berdasarkan urutan abjad.
NB: jenis cabang alkana yang sering dijumpai adalah gugus alkil yang
mana senyawa alkana yang kehilangan 1 atom H. Penamaan sama dengan
alkana, tetapi akhiran –ana diganti menjadi –il dengan rumus umum CnH2n+1.Isomer alkana
Isomer adalah suatu senyawa yang memiliki rumus molekul sama, namun rumus strukturnya berbeda.
Contoh : isomer dari heksana, C6H14.
Sifat-sifat alkana
1. Sifat fisis
a. Merupakan senyawa nonpolar
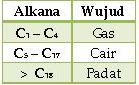
b. Bentuk alkana pada suhu kamar berbeda-beda.
c. Semakin banyak jumlah atom C, semakin
tinggi titik didihnya. Hal ini disebabkan diperlukan energi yang banyak
untuk memutuskan ikatan atom C dengan atom C yang lain pada rantai
utama.
d. Rantai cabang pada senyawa alkana
menurunkan titik didihnya karena ikatan gugus alkil dengan rantai utama
tidak terlalu kuat sehingga tidak memerlukan energi yang banyak untuk
melepaskan gugus alkilnya.
e. Lebih ringan dari air
2. Sifat kimia
a. Tidak reaktif, cukup stabil apabila dibandingkan dengan senyawa organik lainnya.
b. Dapat bereaksi dengan halogen yang mana salah satu atom H diganti oleh halogen. Reaksi ini disebut reaksi halogenasi dan menghasilkan alkil halida.
Contoh : CH4 + Cl2 → CH3Cl + HCl
c. Dapat dibakar sempurna menghasilkan CO2 dan H2O.
Contoh : CH4 + 2O2 → CO2 + 2H2O
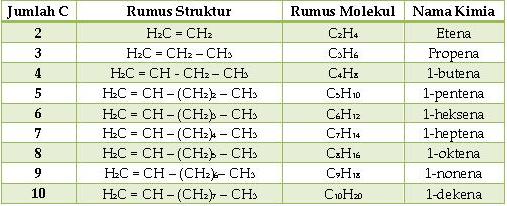
2. Alkena
Merupakan senyawa hidrokarbon tidak jenuh dengan ikatan rangkap dua ( – C = C – ).
Rumus umum : CnH2n.
Tata nama alkena
1. Alkena rantai lurus : atom C yang
berikatan rangkap diberi nomor yang menunjukkan ikatan tersebut dan
penomoraqn dimulai dari rantai yang paling dekat dengan ikatan rangkap.
Contoh :
2. Nama senyawa diatas adalah 2-pentena
a. Alkena dengan rantai bercabang
b. Rantai utama yaitu rantai terpanjang dan mengandung ikatan rangkap.
c. Penomoran rantai diawali dari yang paling dekat dengan ikatan rangkap, bukan cabang yang terdekat.
d. Urutan penulisan nama: nomor cabang, naman cabang, nomor ikatan rangkap, nama alkena.
Contoh:
3. Alkena dengan lebih dari satu ikatan
rangkap : namanya diberi tambahan diena ( jika jumlah ikatan rangkap ada
2), atau triena ( jika jumlah ikatan rankap ada 3).
Contoh :
Isomer alkenaAda dua jenis isomer alkena, yaitu:
1. Isomer posisi : senyawa-senyawa dengan
rumus molekul sama, namun memiliki penataan atom yang berbeda. Alkena
memiliki dua jenis perubahan penataan atom, yaitu:
a. Perubahan posisi yang dialami oleh ikatan rangkap
Contoh : Butena
b. Perubahan posisi yang dialami oleh rantai cabang
Contoh : 2-metil-1-butena
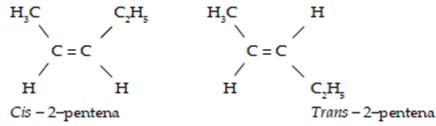
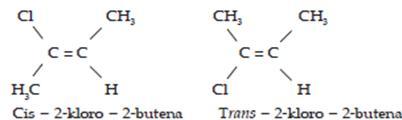
2. Isomer geometri : atom C yang berikatan rangkap harus mengikat dua gugus atom yang berlainan.
Contoh :
Isomer geometri dari 2-pentena → H3C – CH = CH – CH2 – CH3
NB : 1. Halida lebih diprioritaskan daripada alkil.
2.Atom C yang lebih banyak, lebih diprioritaskan.
Sifat alkena- Sifat fisika : sedikit larut dalam air. Hal ini disebabkan karena adanya ikatan rangkap yang membentuk ikatan p. Ikatan p tersebut akan ditarik oleh hydrogen dari air yang bermuatan positif.
- Sifat kimia
a. Oksidasi ( pembakaran) : menghasilkan CO2 dan H2O.
Contoh : 2C3H6 + 9O2 → 6CO2 + 6H2O
b. Adisi H2 : reaksi pemutusan ikatan rangkap yang mana ikatan rangkap berubah menjadi ikatan tunggal.
Contoh : CH2 = CH – CH3 + H2 → CH3 – CH2 – CH3
c. Adisi Halogen ( F2, Br2, I2)
: memutuskan ikatan rangkap pada alkena menjadi alkana dengan mengikuti
aturan Markovnikof ( atom H dari asam halide akan terikat pada atom C
yang memiliki atom H paling banyak). Jika atom C yang berikatan rangkap
memiliki jumlah atom H sama banyak, maka halide akan terikat pada atom C
yang paling panjang.
Contoh :
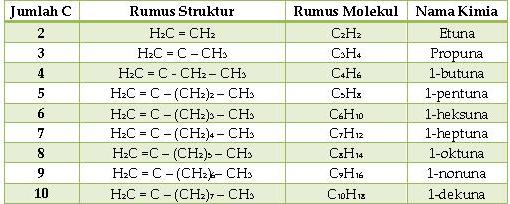
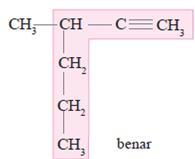
3. Alkuna
Merupakan hidrokarbon tidak jenuh yang memiliki ikatan rangkap tiga ( – C ≡ C – ).
Rumus umum : CnH2n-2
Tata nama alkuna
1. Menentukan rantai utama
2. Penomoran alkuna dimulai dari salah
satu ujung rantai induk, sehingga atom C yang berikatan rangkap tiga
mendapat nomor terkecil.
3. Penamaan : nomor cabang, nama cabang, nomor atom C yang berikatan rangkap 3, nama rantai induk.
Contoh :
HC ≡ C – CH3 →1-propuna
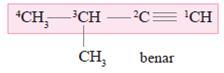
Isomer AlkunaAlkuna hanya memiliki isomer posisi. Akibat pengaruh ikatan rangkap, isomer posisi alkuna mengalami dua jenis penggeseran penataan atom, yaitu :
1. Perubahan posisi dialami oleh ikatan rangkap
2. Perubahan posisi dialami oleh rantai cabang
Sifat alkuna- Sifat fisika : sedikit larut dalam air.
- Sifat kimia
a. Oksidasi : jika dibakar sempurna akan menghasilkan CO2 dan H2O
Contoh : C3H4 + 4O2 → 3CO2 + H2O
b. Adisi H2 : mengalami dua kali adisi oleh H2 untuk menghasilkan alkana.
Contoh :
c. Adisi halogen
Contoh :
d. Adisi asam halida : mengikuti aturan Markovnikov sebagaimana pada alkena
Contoh :
QUICK WAYUntuk mempermudah membedakan alkana, alkena, dan alkuna dapat mengingat huruf sesudah “k”.
ALKANA : berarti tambah 2 dengan rumus CnH2n+2
ALKENA : berarti tetap ( tidak mengalami penambahan atau pengurangan ) dengan rumus CnH2n
ALKUNA : berarti kurang 2 dengan rumus CnH2n-2
Untuk Menguji Pemahaman jawablah Soal Hidrokarbon

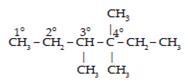
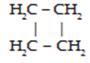

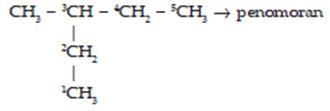
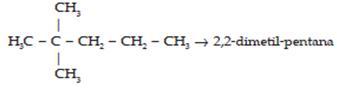
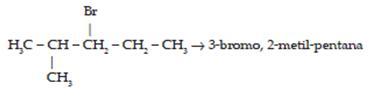

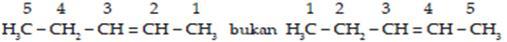
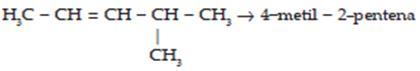
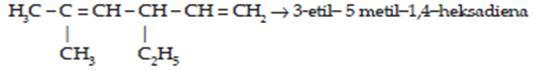
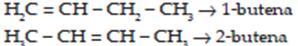
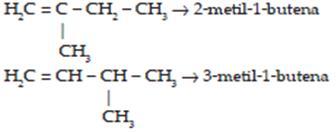
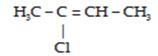
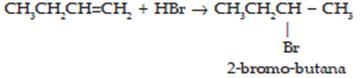
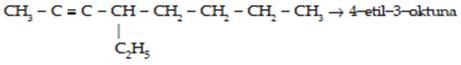
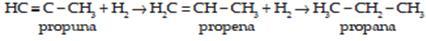
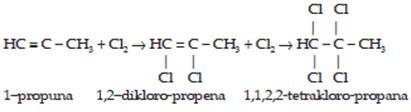
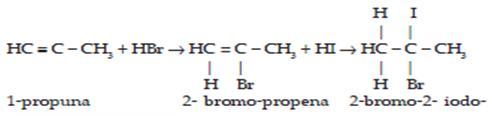
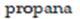


No comments:
Post a Comment