Kenaikan titik didih (ΔTb) dan penurunan titik beku (ΔTf)
Setiap zat cair pada suhu tertentu mempunyai tekanan uap jenuh tertentu dan mempunyai harga yang tetap. Zat cair akan mendidih dalam keadaan terbuka jikatekanan uap jenuhnya sama dengan tekanan atmosfer. Pada saat udara mempunyai tekanan 1 atm, air mendidih pada suhu 100°C, tetapi jika dalam zat cair itu dilarutkan suatu zat, maka tekanan uap jenuh air itu akan berkurang. Penurunan tekanan uap jenuh larutan yang lebih rendah dibanding tekanan uap jenuh pelarut murni menyebabkan
titik didih larutan lebih tinggi daripada titik didih pelarut murni.
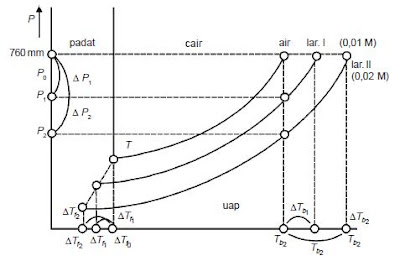
Diagram penurunan tekanan uap, titik beku, dan kenaikan titik didih
Selisih antara titik didih suatu larutan dengan titik didih pelarut murni disebut kenaikan titik didih larutan (ΔTb).
ΔTb = Tb larutan −Tb pelarut murni
Berdasarkan gambar di atas, dapat dilihat bahwa tekanan uap larutan lebih rendah daripada tekanan uap pelarut murni. Hal ini menyebabkan penurunan titik beku
larutan lebih rendah dibandingkan dengan penurunan titik beku pelarut murni. Selisih temperatur titik beku larutan dengan titik beku pelarut murni disebut penurunan titik
beku (ΔTf).
ΔTf = Tf pelarut murni −Tf larutan
Menurut Hukum Backman dan Raoult bahwa penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang terlarut di dalamnya.
Hukum tersebut dapat dirumuskan sebagai berikut.
ΔTb = m×Kf
ΔTf = m×Kf
Keterangan:
ΔTb = kenaikan titik didih
Kb = tetapan kenaikan titik didih molal
ΔTf = penurunan titik beku
Kf = tetapan titik beku molal
m = molalitas
Syarat Hukum Backman dan Raoult adalah sebagai berikut.
a. Rumus di atas berlaku untuk larutan nonelektrolit.
b. ΔTb tidak berlaku untuk larutan yang mudah menguap.
c. Hanya berlaku untuk larutan yang sangat encer, pada
larutan yang pekat terdapat penyimpangan.
Contoh soal:
1. Tentukan titik didih dan titik beku larutan berikut!
a. urea (CO(NH2)2) 30 gram dalam 500 gram air.
b. glukosa (C6H12O6) 18 gram dalam 10 gram air.
(Kb air = 0,52 dan Kf air = 1,86 °C/m)
Jawab:
a. ΔTb = m × Kb
= 30/60 gram× 1.000/500 gram× 0,52 °C/m
= 0,5 gram × 2 gram × 0,52 °C/m
= 0,52 °C
Titik didih larutan = 100 °C + 0,52 °C =
100,52 °C.
ΔTb = m × Kb
= 30/60gram x 1.000/500 gram x 1,86 °C/m
= 0,5 gram × 2 gram × 1,86 °C/m
= 1,86 °C
b. ΔTb = m × Kb
= 18/180 gram x 1.000/10gram x 0,52 °C/m
= 0,1 gram × 100 gram × 0,52 °C/m
= 0,52 °C
Titik didih larutan = 100 °C + 5,2 °C = 105,2 °C.
ΔTf = m × Kf
= 18/180 gram x 1.000/10 gram x 1,86 °C/m
= 0,1 gram × 100 gram × 1,86 °C/m
= 10 gram × 1,86 °C
= 18,6 °C
Titik beku larutan = 0 °C – 18,6 °C = –18,6 °C.
2. Titik beku larutan 64 gram naftalena dalam 100 gram benzena adalah 2,91 °C. Jika titik beku benzena 5,46°C dan tetapan titik beku molal benzena 5,1 °C, maka
tentukan massa molekul relatif naftalena!
Jawab:
ΔTf = m × Kf
ΔTf = massa benzena/Mr x 1.000/p x Kf
ΔTf = 5,46 °C – 2,91 °C = 2,55 °C
2,55 = 6,4 gram/Mr× 1.000 gram/100 × 5,1 °C
Mr=(6,4 x 1.000 x 5,1 °C ):(2,55 x 100 )
Mr = 128
3. Berapa berat gula yang harus dilarutkan untuk menaikkan titik didih 250 mL air menjadi 100,1°C pada tekanan 1 atm, jika Mr gula = 342 dan Kb = 0,5 °C/m?
Jawab:
ΔTb = massa gula/Mr × 1.000/p × Kb
ΔTb = 100,1°C – 100°C
= 0,1°C
0,1 = massa gula/342 × 1.000mL/250 × 0,5 °C/m
0,1 °C = massa gula/342 x 4 mLx 0,5 °C/m
0,1 °C = massa gula/342 x 2
0,1 °C × 342 = massa gula × 2
massa gula =34,2/2 = 17,1 gram
Jadi, berat gula adalah 17,1 gram.



No comments:
Post a Comment