Berbagai macam reaksi kimia tanpa kita sadari, begitu akrab dengan kehidupan kita.
- Pernahkah Anda melihat besi maupun seng berkarat?
- Benda perhiasan yang disepuh kembali karena warnanya yang pudar?
- Energi listrik yang ditimbulkan oleh aki kendaran bermotor?
- Atau yang lebih sederhana ketika kita mengupas buah apel, beberapa saat akan terjadi perubahan warna. Mengapa hal itu bisa terjadi?
Semua kejadian atau peristiwa di atas merupakan contoh dari reaksi
oksidasi atau reduksi yang akrab kita sebut sebagai reaksi redoks.
- Konsep redoks berdasarkan pelepasan dan pengikatan oksigen.
- Konsep redoks berdasarkan pelepasan dan penerimaan elektron.
- Konsep redoks berdasarkan kenaikan dan penurunan bilangan oksidasi.
A. KONSEP REAKSI
OKSIDASI REDUKSI
Pengertian oksidasi dan reduksi dapat ditinjau berdasarkan 3 landasan teori,
yaitu :
1. Reaksi Pengikatan dan
pelepasan unsur oksigen
Reaksi oksidasi (pengoksigenan) adalah peristiwa penggabungan suatu zat dengan oksigen.
Contoh:
1) Perkaratan logam besi
Reaksi perkaratan logam besi:
4Fe(s) + 3O2(g) --> 2Fe2O3(s) [karat besi]
2) Pembakaran bahan bakar (misalnya gas metana, minyak tanah, LPG, solar)
Reaksi pembakaran gas metana (CH4): akan menghasilkan gas karbon dioksida dan uap air.
CH4(g) + O2(g) --> CO2(g) + 2H2O(g)
3) Oksidasi glukosa (C6H12O6) dalam
tubuh (respirasi). Di dalam tubuh, glukosa di pecah menjadi senyawa yang
lebih sederhana seperti carbon dioksida dan air.
C6H12O6(aq) + 6O2(g) --> 6CO2(g) + 6H2O(l)
4) Oksidasi tembaga Cu, belarang S, dan belerang dioksida SO2:
Cu(s) + O2(g) --> CuO(s)
S(s) + O2(g) --> SO2(g)
SO2(g) + O2(g) --> SO3(g)
5) Buah apel maupun pisang setelah dikupas akan berubah warna menjadi kecoklatan
6) Minyak makan yang disimpan terlalu lama dan dalam kondisi terbuka akan menyebabkan bau tengik hasil dari pengikatan oksigen (teroksidasi)
7) Menurut Anda, contoh apa lagi yang terkait dengan peristiwa oksidasi berdasarkan konsep pertama? Silakan tambahkan di sini !!
Zat yang mengikat oksigen kita sebut sebagai reduktor/pereduksi. Berdasarkan contoh-contoh reaksi oksidasi di atas, maka reduktor untuk reaksi: 1) Besi Fe; 2) Metana CH4; 3) Glukosa C6H12O6; 4) Cu, S, SO2
1) Perkaratan logam besi
Reaksi perkaratan logam besi:
4Fe(s) + 3O2(g) --> 2Fe2O3(s) [karat besi]
Reaksi pembakaran gas metana (CH4): akan menghasilkan gas karbon dioksida dan uap air.
CH4(g) + O2(g) --> CO2(g) + 2H2O(g)
C6H12O6(aq) + 6O2(g) --> 6CO2(g) + 6H2O(l)
Cu(s) + O2(g) --> CuO(s)
S(s) + O2(g) --> SO2(g)
SO2(g) + O2(g) --> SO3(g)
6) Minyak makan yang disimpan terlalu lama dan dalam kondisi terbuka akan menyebabkan bau tengik hasil dari pengikatan oksigen (teroksidasi)
7) Menurut Anda, contoh apa lagi yang terkait dengan peristiwa oksidasi berdasarkan konsep pertama? Silakan tambahkan di sini !!
Si
+ O2 → SiO2
4 Fe
+ 3 O2 → 2 Fe2O3
Reaksi
oksidasi logam dikenal juga dengan nama perkaratan. Reaksi pembakaran juga
termasuk reaksi oksidasi, misalnya pembakaran minyak bumi, kertas, kayu bakar,
dll.
Reaksi reduksi adalah peristiwa pengeluaran oksigen dari suatu zat.
Contoh:
Cr2O3(s) + 2Al(s) --> 2Cr(s) + Al2O3(s)
3) Reduksi tembaga(II) oksida CuO oleh gas hidrogen H2
CuO(s) + H2(g) --> Cu(s) + H2O(g)
4) Reduksi SO3, KClO3, dan KNO3:
SO3(g) --> SO2(g) + O2(g)
3KClO3(s) --> 2KCl(s) + 3O2(g)
2KNO3(aq) --> 2KNO2(aq) + O2(g)
Zat yang melepas oksigen kita sebut sebagai oksidator/pengoksidasi. Berdasarkan contoh-contoh reaksi reduksi di atas, maka oksidator untuk reaksi: 1) Hematit Fe2O3; 2) Kromium(III) oksida Cr2O3; 3) Tembaga(II) oksida CuO; 4) SO3, KClO3, KNO3
1) Reduksi mineral hematit F2O3 oleh karbon monoksida CO
F2O3(s) + CO(g) --> 2Fe(s) + CO2(g)
2) Reduksi kromium(III) oksida Cr2O3 oleh aluminium Al
CuO(s) + H2(g) --> Cu(s) + H2O(g)
SO3(g) --> SO2(g) + O2(g)
3KClO3(s) --> 2KCl(s) + 3O2(g)
2KNO3(aq) --> 2KNO2(aq) + O2(g)
2 CuO
→
2 Cu + O2
H2O → H2 + O2
2. Reaksi
pelepasan dan pengikatan elektron
Reaksi oksidasi dan reduksi juga dapat dibedakan dari pelepasan dan penangkapan
elektron.
Oksidasi adalah peristiwa pelepasan elektron
Contoh:
Na → Na + + e
Na → Na + + e
Zn
→ Zn +2 + 2e
Al
→ Al +3 + 3e
Reduksi adalah peristiwa penangkapan elektron
Contoh:
Na + + e → Na
Fe +3 + e → Fe +2
Dari konsep kedua ini
dapat disimpulkan bahwa reaksi oksidasi dan reduksi tidak hanya hanya
melibatkan reaksi suatu zat dengan oksigen.
Zat yang melepas elektron (oksidasi) disebut reduktor, sedangkan zat yang menerima elektron (reduksi) disebut oksidator.
Zat yang melepas elektron (oksidasi) disebut reduktor, sedangkan zat yang menerima elektron (reduksi) disebut oksidator.
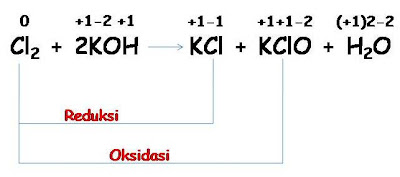
3. Reaksi penambahan dan
pengurangan bilangan oksidasi
Oksidasi adalah peristiwa naiknya / bertambahnya bilangan oksidasi suatu unsur,
sedangkan reduksi adalah peristiwa turunnya / berkurangnya bilangan oksidasi.
B. BILANGAN OKSIDASI
Bilangan oksidasi ( biloks) disebut juga tingkat oksidasi. Bilangan oksidasi
diartikan sebagai muatan yang dimiliki suatu atom dalam keadaan bebas atau
dalam senyawa yang dibentuknya.
Bilangan oksidasi suatu unsur dapat ditentukan dengan aturan berikut:
1. Biloks atom dalam
unsur adalah nol
Contoh Na, Fe, O2 , H2 memiliki biloks
nol
2. Total biloks senyawa
adalah nol
Contoh
H2O, NaOH, CH3COOH, KNO3 total biloksnya adalah nol
3. Biloks ion sesuai
dengan muatannya
Contoh Na +1 ( = +1), O -2 ( = -2), Fe +3 (= +3)
4. Biloks unsur golongan
I A dalam senyawanya adalah + 1
Contoh Biloks atom Na dalam NaCl adalah + 1
5. Biloks unsur golongan
II A dalam senyawanya adalah + 2
Contoh: Biloks Ca dalam CaCO3 adalah + 2
6. Biloks unsur golongan
VII A dalam senyawa binernya adalah – 1
Contoh: Biloks F dalam senyawa KF dan BaF2 adalah – 1
7. Biloks unsur oksigen
dalam senyawanya adalah – 2
Contoh dalam H2O, Na2O, Al2O3
8. Biloks unsur hydrogen
dalam senyawanya adalah + 1
Contoh dalam H2O, HCl, H2SO4
Catatan Penting:
Biloks H = -1 dalam senyawa hidrida misal NaH, LiH, CaH2
Biloks
O = -1 dalam senyawa peroksida misal H2O2
Silahkan selesaikan soal
berikut ini!
Tentukan Biloks unsur
yang digarisbawahi di bawah ini
1. HNO3
2. KMnO4
3. H2SO4
4. SrCO3
5. KClO2
6. NH4 +
7. CaC2O4
8. CH3OH
9. PO4 -3
10. Cu(NO3)2
11. CrCl3
12. Mn(OH)2
13. Co2(SO3)3
14. P2O5
15. CH3ONa
C. OKSIDATOR DAN
REDUKTOR
Oksidator adalah istilah untuk zat yang mengalami reduksi (biloksnya turun),
sedangkan Reduktor adalah zat yang mengalami reaksi oksidasi (biloksnya
naik/bertambah).
Contoh:
Pada reaksi 2Na +
2H2O → 2NaOH
+ H2
Reduktor adalah Na sebab biloksnya naik dari 0 ke +1
Oksidator adalah H2O sebab biloks H berubah
dari +1 ke 0
Selesaikan soal berikut
ini!
1. Tentukan termasuk
oksidasi atau reduksi
a. IO3 - → I2
b. Cl2 →
ClO
–
c.
AsO3 3- → AsH3
d.
Cr 2+ →
CrO4 -2
e.
C2O4-2 → CO2
2. Tentukan oksidator
dan reduktor dari persamaan reaksi berikut
a.
Sn + SnCl4 →
2 SnCl2
b.
Zn + 2HCl → ZnCl2 + H2
c.
2KI + Cl2 → 2KCl + I2
d.
CO2 + 2NaOH → Na2CO3 + H2O
e.
MnO2 + 4HBr → MnBr2 + 2H2O + Br2
f.
2KMnO4 + 5H2C2O4 + 3H2SO4 →K2SO4 + 2MnSO4 + 10 CO2 + 8 H2O
g.
Fe2O3 + HCl → FeCl3 + H2O
D. TATA NAMA
SENYAWA
Senyawa
biner adalah senyawa yang dibentuk oleh dua macam unsur, dapat terdiri
ataslogam dan non logam atau keduanya non logam. Untuk senyawa yang terdiri
atas logam dan non logam, maka unsur logam dituliskan terlebih dahulu diikuti
dengan non logam.
Untuk
unsur-unsur logam yang mempunyai lebih dari satu macam bilangan oksidasi diberi
nama berdasarkan system Stock, yaitu dengan membubuhkan angka Romawi yang
sesuai dengan bilangan oksidasi unsure logam dalam tanda kurung dibelakang nama
logam dan diikuti nama unsure non logam dengan akhiran ida.
Contoh:
FeCl2 :
besi(II)klorida
FeCl3 :
besi(III)klorida
Cu2O :
tembaga(I)oksida
CuO : tembaga(II)oksida
SnCl2 :
timah(II)klorida
SnCl4 :
timah(IV)klorida
Latihan: Tuliskan rumus
senyawa berikut
1.
besi(II)sulfida
2.
raksa(I)klorida
3.
timah(IV)nitrat
4.
kobal(III)karbonat
5.
titan(IV)oksida
6.
raksa(II)sulfat
7.
mangan(II)hidroksida
8.
besi(III)fosfat
E. PENGOLAHAN
LOGAM
Peranan unsur logam dalam kehidupan sehari-hari dapat dilihat dari banyaknya
logam yang digunakan. Antara lain untuk membuat mesin-mesin, kendaraan,
bangunan, pekakas rumah tangga, dan sebagainya. Logam yang banyak digunakan
untuk kesejahteraan manusia diantaranya besi, alumunium, tembaga, perak, emas,
nikel, dan timah.
Pada
umumnya pemisahan logam dari bijihnya dilakukan berdasarkan reaksi reduksi.
Cara reduksi yang paling murah adalah reduksi oksida logam dengan karbon.
Metoda ini cocok dilakukan untuk pengolahan besi dan timah.
Untuk
memperoleh logam dari sulfida logam, mula-mula sulfida logam dipanggang diudara
untuk menghasilkan oksida logam. Kemudian oksida logam direduksi dengan karbon
atau karbon monoksida. Logam-logam yang sangat reaktif seperti alumunium
diperoleh dengan cara elektrolisis.
Beberapa contoh reaksi
pengolahan logam:
a. Pengolahan besi:
Fe2O3
+ 3 CO → 2 Fe + 3 CO2
b. Pengolahan nikel:
2 NiO
+ C →
2 Ni + CO2
c. Pengolahan Alumunium
Al2O3 + C → 4 Al + 3 CO2
d. Pengolahan Timah
SnO2 + C → Sn
+ CO2
e. Pengolahan tembaga
2 Cu2O + Cu2S → 6 Cu + SO2


No comments:
Post a Comment