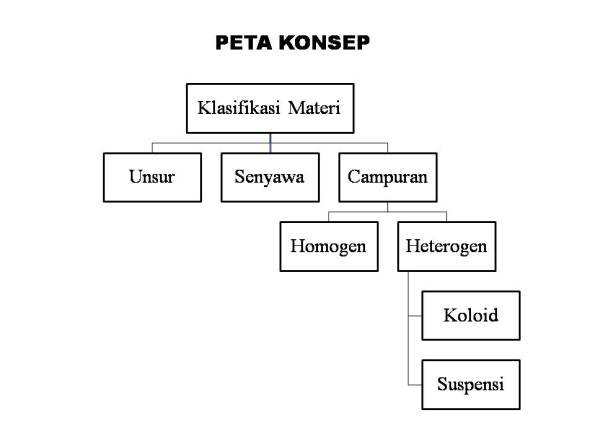
A. UNSUR
Konsep: Unsur adalah zat tunggal yang tidak dapat diuraikan lagi menjadi zat lain dengan reaksi kimia biasa.
Materi tersusun dari beberapa partikel
penyusun. Para ilmuwan mengklasifikasikan zat atau materi menjadi dua
kelompok, yaitu: zat tunggal dan campuran. Unsur dan senyawa termasuk
dalam golongan zat tunggal. Nah, apa yang dimaksud dengan unsur? Unsur
terdiri dari logam dan non logam.
Zat murni memiliki sifat yang membedakan
dengan zat lainnya. Misal, unsur hidrogen hanya tersusun dari atom-atom
hidrogen saja. Unsur oksigen hanya tersusun dari atom-atom oksigen saja.
Sifat oksigen dan hidrogen tidak tampak pada zat yang dibentuk dari
keduanya, misal air (H2O). Di alam terdapat 92 jenis unsur alami,
sedangkan selebihnya adalah unsur buatan. Jumlah keseluruhan unsur di
alam kira-kira 106 jenis unsur.
Unsur dikelompokkan menjadi tiga (3) bagian, yaitu :
1. Unsur logam
Secara umum unsur logam memiliki sifat
berwarna putih mengkilap, mempunyai titik lebur rendah, dapat
menghantarkan arus listrik, dapat ditempa dan dapat menghantarkan kalor
atau panas. Pada umumnya logam merupakan zat padat, namun terdapat satu
unsur logam yang berwujud cair yaitu air raksa. Beberapa unsur logam
yang bermanfaat dalam kehidupan sehari–hari, antara lain:
a. Khrom (Cr) Digunakan untuk bumper mobil, dan campuran dengan baja menjadi stainless steel.
b. Besi (Fe) Merupakan logam yang paling
murah, sebagai campuran dengan karbon menghasilkan baja untuk konstruksi
bangunan, mobil dan rel kereta api.
c. Nikel ( Ni ) Nikel padat sangat tahan
terhadap udara dan air pada suhu biasa, oleh karena itu nikel digunakan
sebagai lapisan pelindung dengan cara disepuh.
d. Tembaga (Cu) Tembaga banyak digunakan
pada kabel listrik, perhiasan, dan uang logam. Campuran tembaga dengan
timah menghasilkan perunggu sedangkan campuran tembaga dengan seng
menghasilkan kuningan.
e. Seng (Zn) Seng dapat digunakan sebagai atap rumah, perkakas rumah tangga, dan pelapis besi untuk mencegah karat.
f. Platina (Pt) Platina digunakan pada
knalpot mobil, kontak listrik, dan dalam bidang kedokteran sebagai
pengaman tulang yang patah.
g. Emas (Au) Emas merupakan logam sangat
tidak reaktif, dan ditemukan dalam bentuk murni. Emas digunakan sebagai
perhiasan dan komponen listrik berkualitas tinggi. Campuran emas dengan
perak banyak digunakan sebagai bahan koin.
2. Unsur non logam
Pada umumnya unsur non logam memiliki
sifat tidak mengkilap, penghantar arus listrik yang buruk, dan tidak
dapat ditempa. Secara umum non logam merupakan penghantar panas yang
buruk, namun terdapat satu unsur non logam yang dapat menghantarkan
panas dengan baik yaitu grafit. Beberapa unsur non logam yang
bermanfaat dalam kehidupan sehari–hari, antara lain:
a. Fluor (F) Senyawa fluorid yang
dicampur dengan pasta gigi berfungsi menguatkan gigi, freon – 12 sebagai
pendingin kulkas dan AC.
b. Brom (Br) Senyawa brom digunakan sebagai obat penenang saraf, film fotografi, dan bahan campuran zat pemadam kebakaran
c. Yodium (I) Senyawa yodium digunakan
sebagai antiseptik luka, tambahan yodium dalam garam dapur, dan sebagai
bahan tes amilum (karbohidrat) dalam industri tepung
3. Unsur semi logam (Metaloid)
Unsur semi logam memiliki sifat antara logam dan non logam. Beberapa unsur semi logam yang bermanfaat dalam kehidupan sehari–hari, antara lain :
Unsur semi logam memiliki sifat antara logam dan non logam. Beberapa unsur semi logam yang bermanfaat dalam kehidupan sehari–hari, antara lain :
a. Silikon (Si) Terdapat di alam
terbanyak kedua setelah oksigen, yakni 28 %dari kerak bumi. Senyawa
silikon banyak digunakan dalam peralatan pemotong dan pengampelasan,
untuk semi konduktor, serta bahan untuk membuat gelas dan keramik.
b. Germanium ( Ge ) Keberadaan germanium
di alam sangat sedikit, diperoleh dari batu bara dan batuan seng pekat.
Germanium merupakan bahan semikonduktor, yaitu pada suhu rendah
berfungsi sebagai isolator sedangkan pada suhu tinggi sebagai konduktor.
Seorang ahli kimia yang bernama Demitri
Mendleev (1834 ~ 1907) mengajukan susunan tabel sistem periodik
unsur-unsur. Bagaimanakah nama dan lambang unsur dituliskan? Banyaknya
unsur yang terdapat di alam cukup menyulitkan kita untuk mengingat-ingat
nama unsur. Oleh karena itu, diperlukan suatu tata cara untuk
memudahkan kita mengingat nama unsur tersebut.
Jons Jacob Berzelius (1779 ~ 1848), memperkenalkan tata cara penulisan nama dan lambang unsur, yaitu :
1. Setiap unsur dilambangkan dengan satu huruf yang diambil dari huruf awal nama unsur tersebut.
2. Lambang unsur ditulis dengan huruf kapital.
3. Untuk unsur yang memiliki huruf awal sama, maka penulisan nama dibedakan dengan cara menambah satu huruf di belakangnya dan ditulis dengan huruf kecil.
2. Lambang unsur ditulis dengan huruf kapital.
3. Untuk unsur yang memiliki huruf awal sama, maka penulisan nama dibedakan dengan cara menambah satu huruf di belakangnya dan ditulis dengan huruf kecil.
Contoh: Unsur Karbon ditulis C, oksigen ditulis O, Aluminium ditulis Al, Kalsium ditulis Ca.
B. SENYAWA
Konsep: Senyawa adalah gabungan dari beberapa unsur yang terbentuk melalui reaksi kimia.
Senyawa memiliki sifat yang berbeda
dengan unsur-unsur penyusunnya. Misal, dua atom hidrogen dengan satu
atom oksigen dapat bergabung membentuk molekul air (H2O). Hidrogen
adalah gas yang sangat ringan dan mudah terbakar, sedangkan oksigen
adalah gas yang terdapat di udara yang sangat diperlukan tubuh kita
untuk pembakaran.
Tampak jelas bahwa sifat air berbeda
dengan sifat hidrogen dan oksigen. Contoh lain senyawa adalah garam
dapur (NaCl). Garam dapur disusun oleh unsur natrium dan unsur klor.
Natrium memiliki sifat logam yang ringan, sedangkan klor adalah suatu
gas beracun. Dua unsur tersebut digabung membentuk garam dapur berupa
mineral yang sangat dibutuhkan oleh tubuh kita.
Senyawa termasuk zat tunggal yang
tersusun dari beberapa unsur dengan perbandingan massa tetap. Di alam
ini terdapat kurang lebih 10 juta senyawa. Air (H2O) merupakan senyawa
paling banyak terdapat di alam.
Bagaimanakah tata cara penulisan senyawa?
Senyawa dituliskan dalam wujud rumus kimia. Rumus kimia adalah zat yang
terdiri dari kumpulan lambang-lambang unsur dengan komposisi tertentu.
Komposisi tersebut berupa bilangan yang menyatakan jumlah atom
penyusunnya (angka indeks). Misal, suatu senyawa terdiri dari atom unsur
natrium (Na) dan atom unsur klor (Cl). Jika angka indeks masing-masing
atom unsur adalah 1 dan 1, maka rumus kimia senyawa yang dibentuk
sebagai berikut :
Angka indeks Na = 1, angka indeks Cl = 1, Jadi rumus kimia senyawa tersebut adalah NaCl ( Natrium klorida ).
Angka indeks Na = 1, angka indeks Cl = 1, Jadi rumus kimia senyawa tersebut adalah NaCl ( Natrium klorida ).
Rumus kimia dapat berupa rumus molekul dan rumus empiris. Rumus molekul adalah rumus kimia yang menyatakan jenis dan jumlah atom yang menyusun zat. Misal, C2H4 (Etena), H2O (air). Rumus empiris
adalah rumus kimia yang menyatakan perbandingan terkecil jumlah
atom–atom pembentuk senyawa. Misal, rumus kimia C2H4, maka rumus
empiris senyawa tersebut adalah CH2.
Joseph Lonis Proust (1754~1826) seorang
ilmuwan dari Perancis mengemukakan hukum perbandingan tetap atau sering
dikenal dengan hukum Proust, yaitu : perbandingan berat unsur-unsur
penyusun senyawa adalah tetap. Eksperimen yang dilakukan Proust adalah
reaksi antara unsur hidrogen dan oksigen sehingga terbentuk air (H2O).
Dari percobaan yang dilakukan oleh Proust ditarik kesimpulan bahwa:
1. Air tersusun dari oksigen dan hidrogen dengan perbandingan massa unsur oksigen banding hidrogen adalah 8 : 1
2. Jumlah zat sebelum dan sesudah reaksi adalah tetap.
2. Jumlah zat sebelum dan sesudah reaksi adalah tetap.
Senyawa-senyawa baru ditemukan dan
dipisahkan dari tumbuh– tumbuhan. Misal, jeruk diketahui mengandung
vitamin C, setelah dilakukan pemisahan ternyata jeruk mengandung asam
askorbat. Struktur vitamin C ditemukan, maka dilakukan sintesis untuk
membuat vitamin C di laboratorium. Rumus senyawa merupakan gabungan
lambang unsur yang menunjukkan jenis unsur pembentuk senyawa dan jumlah
atom masing-masing unsur. Misal, sukrosa memiliki rumus senyawa
C12H22O11. Sukrosa tersusun dari 12 atom karbon, 22 atom hidrogen, dan
11 atom oksigen.
C. CAMPURAN
Konsep: Campuran adalah gabungan beberapa zat dengan perbandingan tidak tetap tanpa melalui reaksi kimia.
Saat kamu membuat minuman teh, zat apa
sajakah yang dicampur? Saat kamu melarutkan garam atau gula pasir ke
dalam gelas yang berisi air, apa yang dapat kamu amati? Nah, simak
penjelasan berikut! Dalam kehidupan sehari-hari banyak kita jumpai
campuran. Misal, air sungai, tanah, udara, makanan, minuman, larutan
garam, larutan gula, dll. Sifat asli zat pembentuk campuran ada yang
masih dapat dibedakan satu sama lain, ada pula yang tidak dapat
dibedakan. Di dalam udara tercampur beberapa unsur yang berupa gas,
antara lain: nitrogen, oksigen, karbon dioksida dan gas-gas lain. Udara
segar yang kita hirup mengandung oksigen yang lebih banyak daripada
udara yang tercemar. Dalam udara juga tersusun dari beberapa senyawa,
antara lain : asap dan deb
Campuran dikelompokkan menjadi dua bagian, yaitu:
1. Campuran Homogen
Campuran antara dua zat atau lebih yang
partikel-partikel penyusun tidak dapat dibedakan lagi disebut campuran
homogen. Campuran homogen sering disebut dengan larutan. Contoh campuran
homogen, antara lain: campuran air dengan gula dinamakan larutan
gula, campuran air dengan garam dinamakan larutan garam. Ukuran
partikel dalam larutan memiliki diameter sekitar 0,000000001 m, dan
tidak dapat dilihat dengan mikroskop. Beberapa contoh campuran homogen
di atas adalah campuran antar zat cair. Adakah campuran antar logam,
sehingga terbentuk campuran homogen? Terdapat campuran antara logam
dengan logam lain sehingga terbentuk campuran homogen. Misal, Stainless
steel banyak digunakan untuk keperluan alat-alat kesehatan dan
rumah tangga. Stainless steel merupakan campuran logam besi, krom, dan
nikel.
Tahukah kamu emas merupakan campuran
homogen? Pencampuran logam dilakukan dengan melelehkan logam-logam
tersebut. Campuran logam satu dengan logam lain dinamakan paduan logam.
Emas murni merupakan logam yang lunak, mudah dibengkokkan. Agar
emas menjadi keras sehingga sulit untuk dibengkokkan, maka emas
murni tersebut dicampur dengan logam lain yaitu tembaga. Perhiasan
yang dijual memiliki kadar 22 karat, 20 karat atau 18 karat. Apa arti
kalimat tersebut? Emas murni memiliki kadar 24 karat, sedangkan emas
yang sudah dicampur dengan logam tembaga memiliki kadar 22 karat,
20 karat, atau 18 karat. Semakin sedikit kadar emas yang dimiliki,
semakin banyak kandungan tembaga di dalam emas tersebut. Kadangkala
dalam campuran emas dan tembaga masih dicampur lagi dengan perak.
Hal ini dilakukan agar menambah menarik penampilan emas
tersebut. Campuran antara emas, tembaga dan perak menghasilkan
emas berwarna putih yang biasa disebut emas putih.
Jenis campuran homogen, antara lain:
campuran gas dalam gas, campuran gas dalam zat cair, campuran gas dalam
zat padat, campuran zat cair dalam zat cair, dan campuran zat padat
dalam zat cair. Coba kamu klasifikasikan zat-zat di sekitarmu yang
termasuk campuran homogen!
2. Campuran Heterogen
Campuran antara dua macam zat atau lebih
yang partikel-partikel penyusunnya masih dapat dibedakan satu sama
lainnya disebut campuran heterogen. Contoh campuran heterogen : tanah,
air sungai, makanan, minuman, air laut, adonan kue, adonan beton cor,
dll. Pada campuran heterogen dinding pembatas antar zat masih
dapat dilihat, misal campuran air dengan minyak, campuran besi dan
pasir, campuran serbuk besi dan air, dll.
Di dalam campuran heterogen dikelompokkan menjadi dua bagian, yaitu :
a. Koloid
Partikel-partikel pada koloid hanya dapat
dilihat dengan mikroskop ultra. Ukuran partikel antara 0,5 m s.d 1 mm.
Contoh koloid: susu, asap, kabut, agar-agar.
b. Suspensi
Partikel-partikel pada suspensi hanya
dapat dilihat dengan mikroskop biasa. Ukuran partikel antara lebih besar
dari 0,3 m. Contoh suspensi: minyak dengan air, air keruh, dan air
kapur.






No comments:
Post a Comment